金属的化学性质
金属的化学性质课后练习(二)
主讲教师:荣顺杰 北师大二附中化学高级教师
题一:往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,你能得出的结论是( )
A.滤渣中一定有Fe B.滤渣中一定有Cu
C.滤液中一定有Fe2+ D.滤液中一定有Ag+、Cu2+
题二:将等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图所示,请回答下列问题。
(1)写出锌与稀硫酸反应的化学方程式 ,该反应的基本类型为 反应;
(2)对于该图像的理解,下列说法正确的是 (填序号)。
①A金属与稀硫酸反应更剧烈;②反应结束后两种金属一定都有剩余;③反应结束后稀硫酸都没有剩余;④反应结束后消耗两种金属的质量相等;⑤反应结束后所得溶液质量相等
 题三:⑴右图标出的是有关灯泡组成的物质,请根据图回答下列问题。
题三:⑴右图标出的是有关灯泡组成的物质,请根据图回答下列问题。
①图中标出物质中属于金属材料的是 ,属于非金属单质
的是 。(各写一种即可)
②物质的性质决定其用途。请你就图中标出的物质举一例
说明: 。
 ⑵(2011·江西)有等质量的A、B两种金属,相对原子质量Ar(A)<Ar(B)。将A放入质量分数为15%的稀硫酸中,B放入质量分数15%的稀盐酸中,在反应中A、B均显正二价,产生氢气的质量随时间变化曲线如图所示。下列说法正确的是( )
⑵(2011·江西)有等质量的A、B两种金属,相对原子质量Ar(A)<Ar(B)。将A放入质量分数为15%的稀硫酸中,B放入质量分数15%的稀盐酸中,在反应中A、B均显正二价,产生氢气的质量随时间变化曲线如图所示。下列说法正确的是( )
A.产生氢气的速率A<B
B.反应A、B一定都有剩余
C.消耗的稀硫酸和稀盐酸的质量一定不相等
D.消耗B的质量一定小于消耗A的质量
题四:通过一年的化学学习,我们已经了解了常见金属在溶液中的活动性顺序。铬(Cr)是重要的金属材料,越来越受到人们的关注。某化学兴趣小组对Cr、 Al、Cu的金属活动性顺序进行探究。过程如下:
[提出假设]⑴对三种金属活动性顺序提出三种可能的假设:
a. Al>Cr>Cu b. Cr>Al>Cu c.
[设计实验]同温下,取大小相同的打磨过的金属薄片,分别投入到等体积、等浓度的足量稀盐酸中,观察现象,记录如下:

[控制实验条件]⑵打磨三种金属发生的是 ① 变化;上述实验使用等浓度的盐酸溶液的理由是 ② 。
[得出结论]⑶原假设中正确的是 ① (填假设中的a、b或c)。写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式: ② 。
[结论应用]⑷根据探究结果,在CuCl2和AlCl3的混合溶液中加入一定量的金属铬,充分反应后过滤,向滤出的固体中加入盐酸,无明显现象,刚滤液中一定含有的溶质是 。
金属的化学性质
课后练习参考答案
题一:C
解析:向滤渣中加入稀盐酸,无气泡产生,说明铁已经与AgNO3、Cu(NO3)2完全发生反应并生成了硝酸亚铁,A项错误、C项正确;由于铜的活动性比银强,即使溶液中有铜生成,生成的铜也会与硝酸银发生化学反应而生成银,可见滤渣中一定有Ag,一定没有Fe,可能有Cu;滤液中一定有Fe2+,可能含有Ag+与Cu2+,B、D项均错误。
题二:(1)Zn+H2SO4=ZnSO4+H2↑;置换反应;(2)①③
解析:(1)金属和酸发生的是置换反应,生成氢气;(2)从图像上来看,A、B与酸反应生成氢气的质量是相等的,说明消耗的稀硫酸质量也是相等的(金属与酸反应产生氢气的实质是金属将酸中的氢元素置换成氢气),A的反应速度比B快(在反应结束前的相同时间间隔内,A产生的氢气比B多),说明A金属与稀硫酸反应更剧烈;根据锌、铁与稀硫酸反应的化学方程式中锌、铁与氢气的质量关系可以得出:产生相同质量的氢气,消耗的锌比铁多,则反应结束后,两种金属可能都有剩余,也可能只有铁剩余(或铁一定有剩余,锌可能有剩余);反应前的溶液质量相同,反应后释放到空气中的氢气质量相同,但溶解在稀硫酸中的金属质量不同,故反应结束后所得溶液质量不相等。只有①、③说法正确
题三:⑴①钨丝(或铜丝、焊锡、铝);氮气 ②钨的熔点高,可用于做灯泡的灯丝[或焊锡的熔点低,可用于焊接;或铝(铜)具有导电性,可用于制造电器;或氮气的化学性质不活泼,可用于灯泡填充气等] ⑵C
解析:⑴钨、铜、锡、铝等金属单质属于金属材料;玻璃是一种混合物,只有灯泡中的填充气——氮气属于非金属单质;图中所示物质各有各的用途,这些物质的用途都是由其性质决定的。如灯泡中铜丝、铝片都是利用了其良好的导电性能,灯泡中用钨丝作灯丝是利用了钨具有较高的熔点,焊锡是利用了其熔点低的性质,用氮气作灯泡的填充气,是利用了氮气的化学性质稳定。
⑵观察题图能够看出,在A完全反应完之前的相同时间内,金属A与酸反应产生的氢气比金属B多,说明产生氢气的速率为:A>B;金属与酸反应产生氢气的实质是金属将酸中的氢元素置换成氢气,两反应产生的氢气质量相同,即所消耗的盐酸(HCl)与硫酸中所含氢元素的质量相同,由于HCl与硫酸中氢元素的质量分数不同,故消耗HCl与硫酸的质量一定不同,而两份酸的溶质质量分数相同,故反应消耗的稀盐酸与稀硫酸的质量一定不相等;根据金属与酸反应的化学方程式中金属与氢气的质量关系可以得出,金属与足量的酸反应产生氢气的质量关系为:产生氢气的质量= ×消耗金属的质量,已知金属A的相对原子质量小于金属B的相对原子质量,且在反应中金属A、B均显+2价,可以列式得:
×消耗金属的质量,已知金属A的相对原子质量小于金属B的相对原子质量,且在反应中金属A、B均显+2价,可以列式得: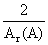 ×mA=
×mA=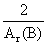 ×mB,则可推断出消耗金属B的质量一定大于消耗金属A的质量,由于反应前金属A与金属B的质量相等,则反应后金属A一定有剩余、金属B可能有剩余。
×mB,则可推断出消耗金属B的质量一定大于消耗金属A的质量,由于反应前金属A与金属B的质量相等,则反应后金属A一定有剩余、金属B可能有剩余。
题四:⑴Al>Cu>Cr ⑵①物理 ②盐酸的浓度不同,会影响反应产生的气体的速率
⑶①a ②Cr+2HCl=CrCl2+H2↑ ⑷AlCl3、CrCl2
解析:⑴已知铝的活动性比铜强,除a、b两种猜想外,还可能存在的假设是铬的活动性比铝、铜都弱,即Al>Cu>Cr;⑵①打磨金属只是使金属的形状发生变化,变化过程中不产生新物质,发生的是物理变化;②根据已有的实验经验可知,反应物的形状(影响反应物间的接触面积)、反应物的浓度、金属活动性的强弱均能影响反应速率,若要比较不同金属的活动性强弱,应控制其他因素不变;⑶①分析表中三金属与盐酸反应的剧烈程度可以得出三金属的活动性顺序;②依据铬在化合物中的化合价,可以写出氯化铬的化学式,进一步完成反应的化学方程式;⑷铬的活动性比铝弱、比铜强,铬能够置换出CuCl2中的铜,而不能够与AlCl3发生化学反应;则将一定量的金属铬投入到CuCl2和AlCl3的混合溶液中,滤出的固体中一定有铜,可能含有未反应的金属铬,但向滤出固体中加入稀盐酸后,却无明显现象发生,则滤渣中一定不含铬;则滤液中一定含有末反应的AlCl3、反应生成的CrCl2,还可能含有没有完全反应的CuCl2。
第二篇:金属的化学性质教学案
《金属的化学性质》教学案
一、学习目标:
1 认识镁,铝,铁,铜等常见金属与氧气的反应。
2 认识常见金属与盐酸,硫酸及某些盐溶液的置换反应,并能解释日常生活中的一些化学现象。
3 能说出常见金属的活动性顺序,并能利用该规律判断置换反应。
学习重点:
常见金属与盐酸,硫酸及某些盐溶液的置换反应
学习难点:
常见金属的活动性顺序,并能利用该规律判断置换反应。
二、学习过程:
探究学习(1):金属与氧气的反应
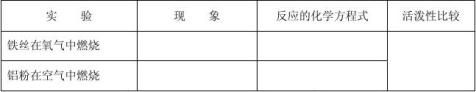
〔结论〕判断活动性的方法一: 。
[思考与讨论]
(1)为什么铝具有优良的抗腐蚀性能?
(2)分析“真金不怕火炼”蕴含的科学原理。
探究学习(2)、金属与稀盐酸、稀硫酸的反应
(1)收集信息:
A组


B组
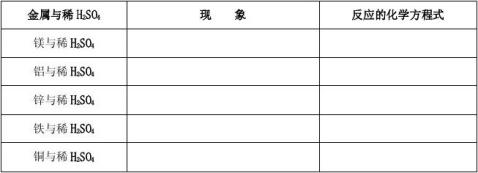
(2)讨论交流实验现象
(3)结论:①上述金属的活动性顺序 。
②判断金属活动性的方法二: 。
根据以上的化学方程式的信息,探究[置换反应]的定义:
定义: 。
特征: 。
探究学习(3)、金属与盐溶液的反应
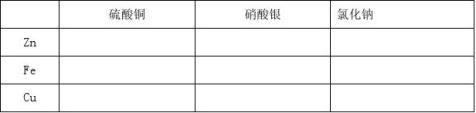
将锌片,铁丝,铜丝三种金属分别放入硫酸铜,硝酸银,氯化钠溶液中,观察并记录实验现象。
结论:锌、铜、铁的活动性顺序:
在金属活动性顺序中,位置在 的金属可以把位于其 的金属从它们的盐溶液中置换出来。
判断金属活动性的方法三: 。
-
金属的化学性质(教学设计与反思)
课题2金属的化学性质教学目标知道铁铝铜等常见金属与氧气的反应初步认识常见金属与盐酸硫酸的置换反应以及与化合物的溶液的反应通过对金属…
-
金属的化学性质教学反思
金属的化学性质教学反思黄坌老区学校韦万兴金属的化学性质的教学重点是放在对金属活动性顺序的探讨上不仅仅是为了获得金属活动性顺序的知识…
-
《金属的化学性质》教学反思
金属的化学性质教学反思纳雍县第四中学化学组王建刚通过本节授课我对教学过程和教学方法进行了反思在总结经验的同时也发现了一些不足成功的…
-
金属的化学性质教学反思
金属的化学性质第一课时教学反思本节课的教学理念通过以化学实验为主的探究活动使学生体验科学研究的过程激发学习化学的兴趣强化科学探究的…
-
金属的化学性质教学设计及教学反思反思
课题2金属的化学性质教学目标知道铁铝铜等常见金属与氧气的反应初步认识常见金属与盐酸硫酸的置换反应以及与化合物的溶液的反应通过对金属…
-
金属的化学性质总结和练习
第三章第一节金属的化学性质1写出下列反应的化学方程式1铝丝插入硫酸铜溶液2在空气中点燃3铜丝与硝酸银溶液反应4镁条放入稀盐酸2钠的…
-
高一化学知识总结:1金属的化学性质
第一节金属的化学性质一教材内容分析本节课内容是在初中学习金属的置换反应以及金属的活动顺序镁等金属与氧气的反应等知识的基础上学习钠铝…
-
金属的化学性质教学反思
金属的化学性质教学反思黄坌老区学校韦万兴金属的化学性质的教学重点是放在对金属活动性顺序的探讨上不仅仅是为了获得金属活动性顺序的知识…
-
金属的化学性质
大石桥慧达学校第一节金属的化学性质1学习目标1运用钠和铝的化学性质解决实际问题2透过现象看本质分析发生反应的内在原因以提高自身观察…
-
金属的化学性质
金属的化学性质第一课时教学设计教学目标知识与技能1了解钠的物理性质和用途2认识钠是一种很活泼的金属掌握钠的化学性质过程与方法1培养…