金属的化学性质总结和练习
第三章第一节金属的化学性质
1、预习探究
1、写出下列反应的化学方程式:
(1)铝丝插入硫酸铜溶液 ; (2)在空气中点燃
(3)铜丝与硝酸银溶液反应 ;(4)镁条放入稀盐酸
2、钠的表面呈 色,有金属光泽,用小刀可切开,说明硬度 (质软),钠在坩埚中加热,很快熔化成一个闪亮的小球,说明钠熔点 ,钠燃烧时产生 火焰,生成 色固体,现在,我们知道钠与氧气反应的产物有两种,它们是 和 。过氧化钠中氧的化合价为 价,在钠燃烧的反应中,氧化剂是 ,还原剂是 ;钠很活泼,一般保存在 中,钠的密度比煤油 。
3、铁、镁、铝等常见金属化学性质比金属钠 ,通常能存放于空气中,其原因是 ;这些金属在 条件下,与氧气也能剧烈反应,甚至 。
达标体验
1.下列有关钠的物理性质的叙述中正确的是( )
①银白色金属 ②质软,可以用小刀切割 ③熔点低于100℃④密度比水小 ⑤热和电的良导体
A.①②④ B.①②③④ C.①③④ D.①②③④⑤
2.以下说法错误的是( )
A.钠在常温下就容易被氧化 B.钠受热后能够着火燃烧 C.钠在空气中缓慢氧化能自燃 D.钠在氧气中燃烧更为激烈
3.从生活常识角度考虑,试推断钠元素在自然界中存在的主要形式是 ( )
A.Na B.NaCl C.NaOH D.Na2O
4、下列关于金属钠的说法中,不正确的是( )
A.钠具有银白色金属光泽,密度比水小 B.钠的还原性很强,在空中易被氧气氧化而变成过氧化钠
C.由于钠的密度比煤油大且不与煤油反应,所以可将少量的钠保存在煤油里
D.钠在上业上用于制氯化钠、氢氧化钠、碳酸钠等化合物
5、下列说法正确的是 ( )
A.铁、镁、铝等能够存放在空气中,是因为它们在常温下与氧气不反应;
B.活泼金属在空气中与氧气反应都会因为生成氧化物保护膜,而不能进一步与氧气反应。
C.金属加热时都能在空气中燃烧 D.活泼性不同金属之间一般可以通过单质与盐溶液反应相互置换。
课时作业
1.在地壳中含量最多的金属元素是 ( ) A.铁 B.氧 C.硅 D.铝
2.一小块钠置于空气中,有下列现象:①变成白色粉末;②变暗;③变成白色固体;④变成液体。上述现象出现的先后顺序是( ) A.①②③④ B.②③④① C.②③①④ D.③②④①
3.下列关于金属铝的叙述中,说法不正确的是 ( )
A.Al 是地壳中含量最多的元素 B.Al 是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C.Al箔在空气中受热可以熔化,且发生剧烈燃烧
D.Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落
4.活泼金属在空气中易与氧气反应,在表面生成一层氧化膜,氧化膜致密,可以保护内层金属不被继续氧化的金属是 ( )
A.铁 B.钠 C.铝 D.镁
5、下列单质与氧气反应,当条件不同,产物不同的是( ) A .钠 B.镁 C.铝 D.铁
6.将金属钠放在燃烧匙中加热使其燃烧,不可能出现的现象是( )
A.金属钠融化为小球 B.火焰为黄色 C.燃烧后得到一白色固体 D.燃烧后得到一淡黄色固体
7.能正确描述金属通性的是( ) A.具有金属光泽 B.易导电、导热 C.具有高熔点 D.具有强还原性
8.下列有关金属元素特征的叙述,正确的是( )
A.金属元素的原子只有还原性,离子只有氧化性 B.金属元素在化合物中一定显正价
C.金属元素在不同的化合物中的化合价相同 D.金属单质在常温下均为固态
9、.钠离子的性质是( ) A、有强还原性 B、有弱氧化性 C、有碱性 D、比钠原子稳定
10.1989年世界卫生组织把铝确定为食品污染源之一而应加以控制使用,铝在下列应用时应加以控制的是①制铝合金②制电线③制炊具④银色漆颜料⑤明矾净水⑥明矾与苏打制食品膨松剂⑦易拉罐⑧用氢氧化铝凝胶制胃舒平药品⑨包装糖果和食品( ) A.③⑤⑧⑨ B.⑥⑧⑨ C.③⑤⑨ D.③⑤⑥⑦⑧⑨
2、预习探究
1、活泼金属在酸性溶液中(活泼金属在中性溶液中)反应一般均有气体 产生,请写出镁与稀盐酸反应的化学方程式: 。能与盐酸,稀硫酸反应的金属是 ;
不能与盐酸,稀硫酸反应的金属是 。
2、钠与水反应的化学方程式和离子方程式为: ; 。
3、写出铁与水蒸汽的反应方程式:
达标体验
1.解释钠投入水中反应产生现象的原因
①钠浮在水面
②钠熔化成闪亮的小球
③小球在水面四处游动,并发出嘶嘶声
④钠逐渐变小,最后完全消失
⑤滴有酚酞的水变红
由此可推知钠与水反应的化学方程式和离子方程式分别为: ,
其中,氧化剂为 ,还原剂为 ,当产生0.2mol H2,会消耗钠的质量为 ,反应中转移电子 mol。
2.在实验室中金属钠一般应保存在 中,原因是①
② ③
3.将金属钠分别投入下列物质的溶液中,有气体放出,且溶液质量减轻的是( )
A.HCl B.K2SO4 C.CuCl2 D.饱和NaOH溶液
4、下列灭火剂能用于扑火金属钠着火的是( )
A、干冰灭火剂 B、黄砂 C、干粉(含NaHCO3)灭火剂 D、泡沫灭火剂
5.将2.3g金属钠放入100g水中,完全反应后溶液的质量分数为( )
A. 100% B.
100% B.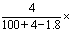 100% C.
100% C. 100% D.
100% D. 100%
100%
课时作业
1.下列离子方程式中,正确的是( )
A.2Na +2H+ ==2Na+ + H2↑ B.2Na+2H2O ==2Na+ +2OH-+ H2↑
C.2Fe + 2H+ ==2Fe3+ + H2↑ D.Na2O2 + H2O ==2Na+ +2OH-+ H2↑
2.下列微粒中,只有氧化性的是( )
A.Fe B.Fe2+ C.Fe3O4 D.Fe3+
3.在Na与H2O的反应中( )
A.Na是氧化剂 B.H2是氧化产物
C.反应实质是钠置换水电离出的少量的H+ D.反应实质是钠置换水中的氢气
4.金属钠与水(滴加少量的酚酞)反应的实验中,下列有关叙述或解释正确的是( )
A.金属钠浮在水面,是因为钠不与水反应 B.溶液呈红色是因为产物中有碱性物质生成
C.钠在水面旋转是因为搅拌 D.没有反应的钠回用手拿出放入原瓶中
5.由Zn、Fe、Al、Mg四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的H2在标准状况下为11.2L,则混合物中一定含有的金属是( )。A、Zn B Fe C Al D Mg
6、把0.5molNa和0.5molMg分别投入到足量的m1g 水中和m2g盐酸中,分别得到溶液a 和b。若 m1= m2,则a与b的质量关系为( )
A、a>b B a<b C a=b D 无法确定
7、金属钠分别与下列物质的溶液反应时,既有气体又有沉淀产生的是( )
A.K2SO4 B.NaHCO3 C.BaCl2 D.CuSO4
8.将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
A.HCl B.NaOH C.K2SO4 D.CuSO4
9.将金属钠投入有5 mL澄清石灰水的试管中,不可能观察到的现象是
A.钠熔成小球并在液面上游动 B.有气体产生 C.溶液底部有银白色物质产生 D.溶液变浑浊
10.下列离子方程式正确的是
A.钠与水的反应:Na+H2O Na++OH-+H2↑ B.钠投入盐酸中:2Na+2H+
Na++OH-+H2↑ B.钠投入盐酸中:2Na+2H+ 2Na++H2↑
2Na++H2↑
C.固体氢氧化钠投入到盐酸中:H++OH- H2O D.钠投入到硫酸亚铁溶液中:2Na+Fe2+
H2O D.钠投入到硫酸亚铁溶液中:2Na+Fe2+ 2Na++Fe
2Na++Fe
11、把4.6g钠投入到95.6g水中,发生化学反应。假设水无蒸发现象,所得溶液中溶质的质量分数是( )
A.4.6% B.7.7% C.8.0% D.10%
12、欲使每10个水分子中溶有1个钠离子,则90ml水中应投入金属钠的质是 ( )
A、10.5g B、11.5g C、21g D、23g
13、在钠、镁、铜、铁中,能与冷水反应的是 ,能与沸水反应的是 ,能与水蒸气反应的
是 写出有关的化学方程式 , , 。
14、 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
(1)写出该反应的反应方程式: ;并指明该氧化还原反应的还原剂是 ,氧化剂是 。
(2)实验前必须对整套装置进行气密性检查,操作方法是 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(4)酒精灯和酒精喷灯点燃的顺序是 ,为什么? 。
 (5)干燥管中盛装是的物质是 ,作用是 。
(5)干燥管中盛装是的物质是 ,作用是 。
(6)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 ,方法是 。这一操作的目的是 。
3、预习探究
1、铝与盐酸反应现象为:开始时几乎不反应,而后缓慢地有气泡生成,最后反应非常剧烈有大量气泡生成,发生反应化学方程式和离子方程式分别为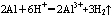 ;
;
2、铝与氢氧化钠溶液反应现象为: 有大量的气泡产生;发生反应化学方程式和离子方程式分别为 2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑ ;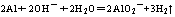
达标体验
1、下列钠的化合物,不可能在自然界稳定存在的是( )
A.氧化物 B. 硫酸盐 C. 硝酸盐 D.氯化物
2.下列各组物质相互反应时,改变反应条件或反应物的质量比,生成的产物也不会改变的是( )
A.钠与氧气 B.澄清石灰水与二氧化碳 C.碳与氧气 D.过氧化钠与水
3、下列有关铝与氢氧化钠溶液反应的说法正确的是:
A.铝作还原剂,氢氧化钠作氧化剂 B.铝被氧化为Al3+,水被氧化为氢气
C.有1mol铝参与反应,转移3mol电子 D.有1mol铝参与反应,产生3mol氢气
4.称取两份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱。若同温同压下放出相同体积的气体,则两份铝粉的质量比为( )
A.1:1 B.2:3 C.3:2 D.1:6
5、有一块表面被氧化成氧化钠的金属钠,质量是10.8g。将它投入到100g水中完全反应后,收集到0.2g氢气,试计算。
⑴未被氧化的金属钠的质量是多少克?
⑵被氧化成氧化钠的金属的质量是多少克?
⑶反应后所得溶液中溶质的质量分数。
课时作业
1.用1mol·L-1BaCl2溶液分别和等体积、等物质的量浓度的下述溶液恰好完全反应,耗用BaCl2溶液体积最大的是( )
A.Na2SO4溶液 B.Fe2(SO4)3溶液 C.FeSO4溶液 D.CuSO4溶液
2.将4.6gNa投入到500mL0.2mol·L-1CuSO4溶液中,假设反应后溶液的体积仍为500mL,则所得溶液的物质的量浓度是( )
A.0.2mol·L-1 B.0.3mol·L-1 C.0.4mol·L-1 D.无法计算
3.200mL0.5mol·L-1盐酸与13.4gNa2CO3·xH2O恰好完全反应,则x值为( )
A.1 B.3 C.7 D.9
4.等量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生H2的量,前者与后者的关系为
A.大于 B.小于 C.等于 D.无法确定
6.两种金属的混合物粉末15g,与足量的盐酸反应时,恰好得到11.2L标准状况下的H2,下列各组金属能构成符合上述条件的混合物的是( )
A.Na和Ag B.Cu和Zn C.Al和Fe D.Mg和Al
7.含MgCl2、KCl、Na2SO4三种溶质的混合溶液,已知其中Cl-为1.5mol,K+和Na+共1.5mol,Mg2+为0.5mol,则SO42-的物质的量为( )
A.1mol B.0.5mol C.0.25mol D.0.15mol
第二篇:高一化学知识总结:1金属的化学性质
第一节 金属的化学性质
一、教材内容分析
本节课内容是在初中学习金属的置换反应以及金属的活动顺序、镁等金属与氧气的反应等知识的基础上,学习钠、铝等活泼金属与氧气的反应,引导学生通过分析对比,掌握越活泼的金属越易与氧气反应的规律。
二、教学对象分析
1.在初三阶段学习了一年的化学知识,对金属的活动顺序、金属与氧气的反应有了初步的了解,懂得通过金属是否能发生置换反应来判断金属的活动顺序。
2、能独立完成一些简单的实验、观察和记录实验现象,在“通过实验探究获得关于物质知识”的方面具有一定能力。
三、教学目标
1、通过阅读课本中的图片、书写有关反应的化学方程式,巩固和加深初中有关金属化学性质的知识和规律
2、通过观察了解金属钠的物理性质及其保存方法,培养学生观察和归纳能力,掌握研究物质的一般方法
3、通过实验了解活泼金属钠、铝与氧气的反应,归纳出活泼金属易与氧气发生反应的知识,了解金属氧化膜在生活生产中的运用,培养学生习惯用化学的视角去观察身边的物质和发生的事情
4、掌握在一般情况下,通过对比金属与氧气反应的条件难易、剧烈程度能反映出金属活动顺序的思维方法
5、通过实验进一步熟悉和规范药品的取用、酒精灯的使用等基本实验技能
四、教学策略
1.举例身边的金属材料和回顾初三化学知识,引入新课,通过对比镁、铝、铁分别与氧气反应引出“钠与氧气怎样反应”的问题。
2.以实验探究的方法,让学生通过实验去探索钠的物理性质、钠在空气中存放所出现的问题以及实验钠与空气中的氧气的反应,并分析其在不同条件下反应的产物;通过铝在空气中加热的现象分析得出金属氧化膜在生产生活中的作用
3.通过四幅金属与氧气在不同条件下反应的图片,结合金属活动顺序表,归纳出金属活动性和金属与氧气的反应、剧烈程度有关
通过图表归纳出钠、铝、铁、铜与氧气反应的有关知识,使知识系统化。
五、教学过程
[引入]在实验室中,有哪些物品是由金属制成的,在家里呢?
[学生回答] 水龙头、铁凳、铁窗筐,铁架台……
[引言]大多数金属元素在自然界中都是以化合态形式存在,说明大多数金属的化学性质比较活泼。今天我们再来进一步学习有关金属的化学性质。
[板书]第一节 金属的化学性质
[学生活动] 根据书本图片,回顾初中阶段学习过的反应,书写有关化学方程式
[提出问题]这些反应都表现了金属具有哪些化学性质?
[归纳复习] 金属与盐反应 金属与酸反应 金属与氧气反应
[板书] 一.金属与氧气的反应
[投影]镁、铝、铁分别与氧气反应的图片。
[设问] 是否金属与氧气的反应都需要加热呢?
[引言]今天我们来认识金属钠与氧气的反应又是怎样的
[板书]1、钠与氧气的反应
[学生活动]分组 ①观察存放在试剂瓶中的金属钠
②把金属钠从试剂瓶中取出观察其物理性质、表面的氧化膜。
[归纳并板书] 金属钠的物理性质与存放方法。
[板书] 常温下 4Na + O2 ==== 2Na2O
白色固体
[提出问题]金属钠放在空气中易被氧化,那么对金属钠进行加热又将如何?
[学生实验]钠的燃烧。
[学生活动]描述实验现象
[设问] 生成物是氧化钠吗?
[学生回答]不是,生成物呈浅黄色,而氧化钠是白色固体
[讲解] 钠在空气中燃烧,生成钠的另一种氧化物---过氧化钠(淡黄色固体)
[板书] 2Na + O2 Δ Na2O2
淡黄色固体
[投影] 过氧化钠的特殊用途-----潜水艇供氧剂。
2Na2O2 + 2H2O == 4NaOH + O2 ↑
2Na2O2 + 2CO2 == 4Na2CO3 + O2
[板书小结]钠的化学性质很活泼,与空气中的氧气在不同的反应条件下生成不同的氧化物
(要求学生写出钠在不同条件下与氧气反应的化学反应方程式,分析氧化剂、还原剂)
[引言]初中我们学习过铝在氧气中的燃烧,若铝在空气中加热,又有什么现象呢?
[板书]2、铝与氧气的反应 4Al+3O2 点燃 2Al2O3
纯氧中:
空气中:
[学生实验]用坩埚钳钳住一块铝片在酒精灯上加热至熔化,轻轻晃动
[描述实验现象] 逐渐熔化,失去光泽,但不滴落
[讲解] 铝的熔点 为665℃ 氧化铝的熔点 为2050℃ ,铝表面的致密氧化膜包在铝的外面,所以熔化了的液态铝不会落下。
[引言]如果我们去掉氧化膜再加热,有什么现象呢?
[学生实验]用坩埚钳钳住一块用砂纸打磨过的铝片在酒精灯上加热至熔化,轻轻晃动
[描述实验现象] 熔化的铝仍不滴落
[师生共同分析原因] 磨去氧化膜的铝片在空气中很快又形成一层新的氧化膜
[板书小结] 铝的化学性质很活泼,容易与空气中的氧气反应形成致密氧化膜而稳定存在于空气中
[回顾]金属与氧气反应的图片、金属活动性顺序表
[设问]能否看出金属的活动性和金属与氧气反应的条件、剧烈程度有什么关系?
[小结]可以看出:金属的活动性越强,与氧气反应就越易进行(如钠露置空气中就氧化);金属活动性越弱,与氧气发生反应时反应条件较高(如铁在空气中不能被点燃),俗语说“真金不怕火炼”就说明金在加热条件下不与氧气反应。
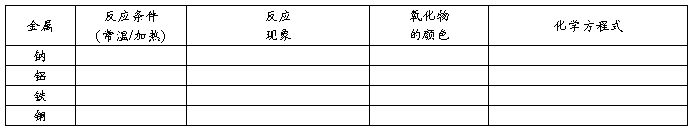
[总结]请学生根据今天所学习内容填写下列表格:
六、板书设计
第三章《金属及其化合物》
第一节金属的化学性质
[板书] 一.金属与氧气的反应
金属钠与氧气的反应
钠的保存及其物理性质
常温下 4Na + O2 ==== 2Na2O 加热 2Na + O2 Δ Na2O2
白色固体 淡黄色固体
小结:钠的化学性质很活泼,与空气在不同的反应条件下生成不同的氧化物
铝与氧气的反应
4Al+3O2 点燃 2Al2O3
纯氧中:
空气中:
[小结]铝的化学性质活泼,容易与空气中的氧气反应形成致密氧化膜而稳定存在于空气中
[总结]钠、铝、铁、铜与氧气的反应
[提出问题]这些反应都表现了金属具有哪些化学性质?
[归纳复习] 金属与盐反应 金属与酸反应 金属与氧气反应
[板书] 一.金属与氧气的反应
[回顾]镁、铝、铁分别与氧气的反应。
[设问] 是否金属与氧气的反应都需要加热呢?
[引言]今天我们来认识金属钠与氧气的反应又是怎样的
[板书]1、钠与氧气的反应
实验3-1
①观察存放在试剂瓶中的金属钠
②把金属钠从试剂瓶中取出观察其物理性质、表面的氧化膜。
[归纳并板书] 金属钠的物理性质与存放方法。

钠一般存放在石蜡或煤油中
[板书] 常温下 4Na + O2 ==== 2Na2O
白色固体
[提出问题]金属钠放在空气中易被氧化,那么对金属钠进行加热又将如何?
实验3-2钠的燃烧。
[学生活动]描述实验现象
[设问] 生成物是氧化钠吗?
[学生回答]不是,生成物呈浅黄色,而氧化钠是白色固体
[讲解] 钠在空气中燃烧,生成钠的另一种氧化物---过氧化钠(淡黄色固体)
[板书] 2Na + O2 Δ Na2O2
淡黄色固体
[投影] 过氧化钠的特殊用途-----潜水艇供氧剂。
2Na2O2 + 2H2O == 4NaOH + O2 ↑
2Na2O2 + 2CO2 == 4Na2CO3 + O2
[板书小结]钠的化学性质很活泼,与空气中的氧气在不同的反应条件下生成不同的氧化物
(要求学生写出钠在不同条件下与氧气反应的化学反应方程式,分析氧化剂、还原剂)
[引言]初中我们学习过铝在氧气中的燃烧,若铝在空气中加热,又有什么现象呢?
[板书]2、铝与氧气的反应
4Al+3O2 点燃 2Al2O3
科学探究
用坩埚钳钳住一块铝片在酒精灯上加热至熔化,轻轻晃动
[描述实验现象] 逐渐熔化,失去光泽,但不滴落
[讲解] 铝的熔点 为665℃ 氧化铝的熔点 为2050℃ ,铝表面的致密氧化膜包在铝的外面,所以熔化了的液态铝不会落下。
[引言]如果我们去掉氧化膜再加热,有什么现象呢?
科学探究
用坩埚钳钳住一块用砂纸打磨过的铝片在酒精灯上加热至熔化,轻轻晃动
[描述实验现象] 熔化的铝仍不滴落
[师生共同分析原因] 磨去氧化膜的铝片在空气中很快又形成一层新的氧化膜
[板书小结] 铝的化学性质很活泼,容易与空气中的氧气反应形成致密氧化膜而稳定存在于空气中
[回顾]金属与氧气反应的图片、金属活动性顺序表
[设问]能否看出金属的活动性和金属与氧气反应的条件、剧烈程度有什么关系?
[小结]可以看出:金属的活动性越强,与氧气反应就越易进行(如钠露置空气中就氧化);金属活动性越弱,与氧气发生反应时反应条件较高(如铁在空气中不能被点燃),俗语说“真金不怕火炼”就说明金在加热条件下不与氧气反应。
[课堂总结]请学生根据今天所学习内容填写下列表格:
1、钠与氧气的反应

小结:钠的化学性质很活泼,与空气在不同的反应条件下生成不同的氧化物
2 铝与氧气的反应
4Al+3O2 点燃 2Al2O3
[小结]铝的作业 1写出钠、铝、铁、铜与氧气的反应的化学方程式
2完成优化设计的有关基础达标题
化学性质活泼,容易与空气的氧气反应形成致密氧化膜而稳定存在于空气
-
金属的化学性质总结和练习
第三章第一节金属的化学性质1写出下列反应的化学方程式1铝丝插入硫酸铜溶液2在空气中点燃3铜丝与硝酸银溶液反应4镁条放入稀盐酸2钠的…
-
金属的化学性质教学反思
金属的化学性质教学反思黄坌老区学校韦万兴金属的化学性质的教学重点是放在对金属活动性顺序的探讨上不仅仅是为了获得金属活动性顺序的知识…
-
金属的化学性质
大石桥慧达学校第一节金属的化学性质1学习目标1运用钠和铝的化学性质解决实际问题2透过现象看本质分析发生反应的内在原因以提高自身观察…
-
金属的化学性质
金属的化学性质课后练习二主讲教师荣顺杰北师大二附中化学高级教师题一往AgNO3和CuNO32的混合溶液中加入一定量的铁粉充分反应后…
-
金属的化学性质
金属的化学性质第一课时教学设计教学目标知识与技能1了解钠的物理性质和用途2认识钠是一种很活泼的金属掌握钠的化学性质过程与方法1培养…
-
高一化学知识总结:1金属的化学性质
第一节金属的化学性质一教材内容分析本节课内容是在初中学习金属的置换反应以及金属的活动顺序镁等金属与氧气的反应等知识的基础上学习钠铝…
-
金属的化学性质教学反思
金属的化学性质教学反思黄坌老区学校韦万兴金属的化学性质的教学重点是放在对金属活动性顺序的探讨上不仅仅是为了获得金属活动性顺序的知识…
-
金属的化学性质
大石桥慧达学校第一节金属的化学性质1学习目标1运用钠和铝的化学性质解决实际问题2透过现象看本质分析发生反应的内在原因以提高自身观察…
-
金属的化学性质
金属的化学性质课后练习二主讲教师荣顺杰北师大二附中化学高级教师题一往AgNO3和CuNO32的混合溶液中加入一定量的铁粉充分反应后…
-
金属的化学性质
金属的化学性质第一课时教学设计教学目标知识与技能1了解钠的物理性质和用途2认识钠是一种很活泼的金属掌握钠的化学性质过程与方法1培养…