金属的化学性质习题(含答案)
1.下列关于金属的叙述中正确的是( )。
A.所有的金属都是固态的
B.金属具有导电性、导热性和延展性
C.活泼的金属、或较活泼的金属能与酸反应,但不能与碱反应
D.金属元素在自然界中都是以化合态存在的
2.地壳里含量最多的金属元素是( )。
A.氧 B.铝 C.硅 D.铁
3.铝在人体中积累可使人慢性中毒,世界卫生组织将铝确定为食品污染源之一而加以控制。铝在下列使用场合中,必须加以控制的是 ( ) 。
A.制造炊具 B.制防锈油漆 C.制铝合金窗 D.炼铝厂制造铝
4.少量钠应保存在( )。
A.密闭容器中 B.水中 C.煤油中 D.汽油中
5.下列关于金属Na的叙述中,说法正确的是( )。
A.Na在空气中燃烧,发出黄色火焰 B.Na在空气中燃烧,产物是Na2O
C.Na是银白色金属,硬度大,熔点高 D.Na常温和加热时反应,产物一样
6.钠着火时,可用来灭火的物质或器材是 ( )。
A. 自来水 B. 沙土 C. 泡沫灭火器 D. 干粉灭火器
7.铝在空气中能够稳定存在的原因是( )。
A.铝的活泼性强 B.铝的还原性差
C.铝与氧气不反应 D.铝表面有氧化膜
8.为了除去铁粉中的少量铝粉,可以选取下列哪种溶液( ) 。
A.浓盐酸 B.硝酸 C.硫酸 D.浓氢氧化钠溶液
9.钠与水反应时的现象与钠的下列性质无关的是 ( )。
A. 钠熔点低 B. 钠的密度小 C. 钠的硬度小 D. 有强还原性
10.金属钠分别与下列溶液反应时,既有气体又有沉淀产生的是 ( )。
A. (NH4)2SO4 B. NaHCO3 C. BaCl2 D. CuSO4
11.下列叙述中,不正确的是 ( )。
A. 钠原子有强还原性,钠离子有弱氧化性
B. Na+离子浓度大的溶液可能显碱性
C. 由于钠很活泼,所以定能从溶液中置换出金属活动性顺序表中钠后面的金属
D. 钠是电和热的良导体
12.将2.3 g钠放入100 g水中,生成溶液中溶质的质量分数是 ( )。
A. 等于2.3% B. 等于4% C. 大于2.3% D. 大于4%
13.足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为( )。
A 1︰2 B 3︰2 C 3︰1 D 6︰1
14若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能共存的是
A. Fe3+、NO3-、Cl-、Na+ B.Ba2+、Mg2+、HCO3-、AlO2-
C.NO3-、Na+、K+、CO32- D.NO3-、K+、AlO2-、OH-
15下列物质中,有一种物质的颜色与其它三种的颜色不同,这种物质是 ( )
A.NaOH B.Na2O C.Na2O2 D.NaHCO3
16.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是 ( )
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.木炭(C)和O2
17.把少量的金属钠分别放入钠放入CuSO4溶液中,现象是______________________________
___________,离子方程式是__________________________________________。
18.碱金属能形成离子型氢化物。如氢化钠的化学式为NaH,其中H-具有较强的还原性。
⑴NaH能与水剧烈反应生成对应的碱和氢气,反应的化学方程式为_________________
___________________, 氧化剂是 ,还原剂是 。
⑵常用NaH在高温下将TiCl4还原成Ti,反应的化学方程式为_____________________
__________________________,氧化剂是 ,还原剂是 。
19.钠与水反应时产生的各种现象如下: ①钠浮在 原因是 ②钠熔化
原因是 ③小球 游动逐渐减小,最后 ;原因是
④发出 声音,原在是 ⑤滴入酚酞后溶
液 ,原因是 。
20.写出下列各步的化学方程式,是离子反应的写出离子方程式。
(1)
(2)
(3)
(4)
(5)
(6)
(7) 
21. 写出下列各化学方程式(是离子反应的写出离子反程式)
(1)铁和水蒸气的反应
(2)铝和氧气的反应
(3)铝和盐酸的反应
(4)铝和氢氧化钠的反应
22.(7分)在铝质易拉罐中收集满CO2气体,然后在其中倒入10mL浓NaOH溶液,并迅速用胶带将易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,可经过一段时间之后,又可以观察到的现象是 。试解释易拉罐变瘪的原因 ;并解释后一现象的原因 。写出反应过程中的两个离子方程式 ; 。
23.(6分)运用比较方法是化学科学中研究物质性质的基本方法之一,请运用比较法解答题
过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:2Na2O2+2CO2=2Na2CO3+O2↑,Na2O2+2CO=Na2CO3。
(1) 试分别写出Na2O2与SO2、SO3反应的化学方程式:
。
。
(2) 通过比较可知,当非金属元素处于 价时,其氧化物与过氧化钠反应有O2生成。
24.(15分) 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
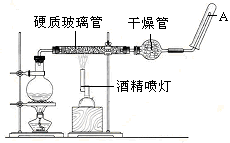
请回答该实验中的问题。
(1)写出该反应的反应方程式: ;并指明该氧化还原反应的还原剂是 ,氧化剂是 。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(3)酒精灯和酒精喷灯点燃的顺序是 ,为什么
25.将质量为1.15g钠用刺了孔的铝箔包裹后放入水中,共收集到1.232L(标准状况)气体。请回答下列问题:(1)1.15g钠与水反应,理论上生成气体的体积(标准状况)为____________L。(2)反应后溶液的体积为100mL,则溶液中NaOH的物质的量浓度为多少?
26.把5.1g镁铝合金粉末放入500mL 1mol/L盐酸中,恰好完全反应。试计算:
(1)该合金中镁和铝的物质的量各为多少mol。
(2)将等质量的该合金投入足量的氢氧化钠溶液中,求标况下放出气体的体积。
参 考 答 案
一、选择题1.B 2. B 3. A 4.C 5.A 6.B 7. D 8.D 9.C 10.D 11.C 12.C 13.B 14.B 15.C16 C(
17.(每空2分)①钠浮在液面上,很快熔化成小球,钠球在水面上四处游动,并发出嘶嘶的响声;2Na+2H2O=2NaOH+H2↑ ②溶液中有蓝色沉淀产生;2NaOH+CuSO4=Na2 SO4+Cu(OH)2↓(蓝色)
18.(每空分,化学方程式2分)易拉罐又鼓起来;易拉罐中的CO2与浓NaOH反应,致使易拉罐内气压降低,从而使易拉罐被大气压压瘪;浓NaOH与易拉罐(Al)反应产生H2,随着易拉罐内H2量的增多,易拉罐内气压增大;CO2+2OH- =CO32-+H2O;2Al+2OH-+2H2O=2 +3H2
+3H2
19.(每空2分)(1) SO2+Na2O2=Na2SO4;SO3+Na2O2=Na2SO4+O2;(2) 最高
20.(每空1分,化学方程式2分)(1)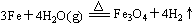 ;Fe;H2O
;Fe;H2O
(2)在玻璃管口A处接一断乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好。
(3)为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;防止爆沸事故的发生。
25 .1.15gNa物质的量为0.05mol 可产生氢气的量 0.025mol 体积0.56L<1.232L
说明铝箔参加了反应 产生H2 1.232-0.56 = 0.672L 物质的量0.03mol
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
产生0.03molH2 消耗NaOH 0.02mol
溶液中NaOH的物质的量 0.05 - 0.02 = 0.03mol
溶液中NaOH的物质的量浓度为 0.03/0.1L = 0.3mol/L
赞同
氧化的金属钠中Na及Na2O2物质的量0.03mol和0.01mol
26设Al为x mol,Mg为 y mol,
那么27x+24y=5.1………………①
因为1mol Al能与3mol HCL反应,1 mol Mg能与 2 mol HCl反应
那么3x+2y=0.5………………②
可解得x=0.1,y=0.2
该合金中镁和铝的物质的量都是0.1 mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
1 mol Al 可与NaOH反应放出1.5 mol H2
0.1 mol Al可放出0.15 mol H2
V= 22.4*0.1*3/2=3.36L
第二篇:金属的化学性质典型例题
金属的化学性质典型例题
例1.铁是一种化学性质比较活泼的金属,在一定条件下能跟多种物质发生化学反应。回答下列问题:
(1)以铁为研究对象,仿照图中实例在框图处填写物质的化学式(所填写的反应物不属同一类别的物质,生成物必须填写铁的化合物)
(2)实验室中要除去细碎铜屑中的少量铁屑,请用化学方法和物理方法将其除去。(只用简单的原理描述即可)
解析:本题主要考查铁的性质。作为一种比较活泼的金属单质,铁能够和氧气等非金属单质、稀酸及某些盐溶液发生反应。
应当注意的是,铁参与的置换反应都生成亚铁盐,如铁与稀硫酸的反应是:Fe+H2SO4 =FeSO4 +H2↑。
在解答第1问时必须按照题后括号内的要求,紧密结合物质分类的知识加以填空。 铁和铜在物理性质、化学性质上都有着较大的区别,运用这些性质上的差异,可以采取多种方法将二者加以分离或把作为杂质的其中一种物质除去。必须注意,除杂和分离无论在目的还是在方法步骤上都有着一定的区别,除杂只需把杂质除掉即可,而分离则需要保证各成分保持其原来的数量和性质。
答案:(1)HCl;FeCl2 ;CuSO4 ;FeSO4(其它符合题意的答案均可)。(2)物理方法:用一块磁铁把铜屑中少量的铁屑吸引出来。 化学方法:用盐酸或稀硫酸酸洗后过滤。
例2. 为验证镁、铁、铜三种金属的活动性顺序,可选用的一组物质是( )
A.铜、氯化亚铁溶液、氯化镁溶液
B.铁、铜、氯化镁溶液
C.镁、氯化铜溶液、硫酸亚铁溶液
D.铁、硫酸铜溶液、氯化镁溶液
分析
:不同金属的活动性是不相同的。通常来说,比较金属活动性强弱的方法有二:一
是看金属与稀酸是否发生反应及反应的快慢程度,能与稀酸反应的金属一定比不能与酸反应的金属活泼,与酸反应剧烈的金属较与酸反应不剧烈的金属活泼性要强;二是利用一种金属与另一种金属的盐溶液是否能够发生反应,如果该金属能将另一种金属从它的盐溶液中置换出来,则其活动性就比另一种金属强。因此,要验证镁、铁、铜三种金属的活动性顺序,可选用的一组物质应当是铁、硫酸铜溶液、氯化镁溶液。
答案:D。
例3.将一个塑料小球放入盛有硫酸铜溶液的烧杯中,小球漂浮于液面,将足量的铁粉投入烧杯中,充分反应后,观察到铁粉表面有 色物质析出,有关的化学方程式为 ;若溶液体积变化忽略不计,则塑料小球浸入液体中的体积跟原来相比 (填“变大”或“变小”或“不变”)
解析:这是一道理化综合应用题。首先,由于铁的金属活动性排在铜的前面,所以它能将硫酸铜中的铜置换出来生成红色的铜,同时溶液颜色也由蓝色逐渐变成浅绿色。其次,由于生成的硫酸亚铁质量小于参加反应的硫酸铜的质量,因而形成的溶液的密度小于原溶液的密度,根据阿基米德定律,塑料小球所受浮力将会变小,故浸入液体中的体积跟原来相比变大了。
答案:红;Fe + CuSO4 = FeSO4 + Cu;变大
例4:铁是一种应用十分广泛的金属。下列有关铁的叙述中,不正确的是( )
A.铁制成铁合金可以改善金属的机械性能
B.可用铁桶配制及储存农药波尔多液
C.用铁锅炒茶可使其中增加微量元素
D.铁与稀盐酸、稀硫酸反应可以制备亚铁盐
解析:铁及其化合物是日常生活中最常见的原材料。本题的目的是考查铁的性质。结合学习经验和生活经验,纯铁质软,而其合金的的硬度较大,这就使铁的性能得到了改善;由于铁能置换出硫酸铜溶液中的铜,从而使波尔多液失效,所以我们不能用铁桶来配制和盛放波尔多液;在用铁锅炒茶的过程中,由于机械摩擦力的作用会使一些铁的微小颗粒混入茶中,增加了铁这一微量元素的含量;铁与稀盐酸、稀硫酸反应分别生成氯化亚铁和硫酸亚铁,在这两种物质中,铁都显+2价,它们都属于亚铁盐。
答案:B。
-
金属的化学性质(教学设计与反思)
课题2金属的化学性质教学目标知道铁铝铜等常见金属与氧气的反应初步认识常见金属与盐酸硫酸的置换反应以及与化合物的溶液的反应通过对金属…
-
金属的化学性质教学反思
金属的化学性质教学反思黄坌老区学校韦万兴金属的化学性质的教学重点是放在对金属活动性顺序的探讨上不仅仅是为了获得金属活动性顺序的知识…
-
《金属的化学性质》教学反思
金属的化学性质教学反思纳雍县第四中学化学组王建刚通过本节授课我对教学过程和教学方法进行了反思在总结经验的同时也发现了一些不足成功的…
-
金属的化学性质教学反思
金属的化学性质第一课时教学反思本节课的教学理念通过以化学实验为主的探究活动使学生体验科学研究的过程激发学习化学的兴趣强化科学探究的…
-
金属的化学性质教学设计及教学反思反思
课题2金属的化学性质教学目标知道铁铝铜等常见金属与氧气的反应初步认识常见金属与盐酸硫酸的置换反应以及与化合物的溶液的反应通过对金属…
-
金属的化学性质总结和练习
第三章第一节金属的化学性质1写出下列反应的化学方程式1铝丝插入硫酸铜溶液2在空气中点燃3铜丝与硝酸银溶液反应4镁条放入稀盐酸2钠的…
-
高一化学知识总结:1金属的化学性质
第一节金属的化学性质一教材内容分析本节课内容是在初中学习金属的置换反应以及金属的活动顺序镁等金属与氧气的反应等知识的基础上学习钠铝…
-
金属的化学性质教学反思
金属的化学性质教学反思黄坌老区学校韦万兴金属的化学性质的教学重点是放在对金属活动性顺序的探讨上不仅仅是为了获得金属活动性顺序的知识…
-
金属的化学性质
大石桥慧达学校第一节金属的化学性质1学习目标1运用钠和铝的化学性质解决实际问题2透过现象看本质分析发生反应的内在原因以提高自身观察…
-
金属的化学性质
金属的化学性质课后练习二主讲教师荣顺杰北师大二附中化学高级教师题一往AgNO3和CuNO32的混合溶液中加入一定量的铁粉充分反应后…