质粒转化大肠杆菌实习报告--附实验图片
细胞转基因技术研究进展
1实验内容:原核细胞转基因:大肠杆菌感受态细胞的制备, 转化和鉴定
2实验原理及技术介绍:
细菌质粒是一类双链、闭环的DNA,大小范围从1kb至200kb以上不等。各种质粒都是存在于细胞质中、独立于细胞染 色体之外的自主复制的遗传成份,通常情况下可持续稳定地处于染色体外的游离状态,但在一定条件下也会可逆地整合到寄主染色体上,随着染色体的复制而复制, 并通过细胞分裂传递到后代。但是在自然条件下,很多质粒都可通过细菌接合作用转移到新的宿主内,但在人工构建的质粒载体中,一般不能自行完成从一个细胞到另一个细胞的接合转移。如需将质粒载体转移进受体细菌,需诱导受体细菌产生一种短暂的感受态以摄取外源DNA。
所谓感受态,是指细菌生长过程中的某一阶段的培养物,只有某一生长阶段中的细菌才能作为转化的受体,能接受外源DNA而不将其降解的生理状态。感受态形成后,细胞生理状态会发生改变,出现各种蛋白质和酶,负责供体DNA 的结合和加工等。细胞表面正电荷增加,通透性增加,形成能接受外来的DNA 分子的受体位点等。本实验为了把外源DNA(重组质粒)引入大肠杆菌,就必须先制备能吸收外来DNA分子 $&KiN8?2, 的感受态细胞。在细菌中,能发生感受态细胞是占极少数。而且,细菌的感受态是在短暂时间内发生。目前对感受态细胞能接受外来DNA 分子的本质看法不一。主要有两种假说:一种是局部原生质体化假说——细胞表面的细胞壁结构发生变化,即局部失去细胞壁或局部溶解细胞壁,使DNA 分子能通过质膜进细胞。另一种是 2^ kK2D$o 酶受体假说——感受态细胞的表面形成一种能接受DNA 的酶 位点,使DNA分子能进入细胞。
本实验通过CaCl2对特定的大肠杆菌处理,制备感受态的细菌。这些细菌可使每微克超螺旋质粒DNA,如一些插入目的DNA片段的重组质粒,产生5×106~2×107 个转化的菌落。当质粒与这些大肠杆菌混合后,质粒粘附在大肠杆菌的表面,在42℃的温度时,大肠杆菌出现热休克,质粒可通过大肠杆菌细胞膜上形成的空隙进入菌体内。随后,加入LB培养液,于37℃振动培养可使细菌复苏,并且表达质粒编码的抗生素抗性基因,提高转化效率。转化成功的大肠杆菌可以在相应抗生素培养皿中传代,形成菌落。
本实验以E.coli DH5a菌株为受体细胞,并用CaCl2处理,使其处于感受态,然后与质粒共保温,实现转化。由于质粒带有氨苄青霉素抗性基因(Amp),可通过Amp抗性来筛选转化子。如受体细胞没有转入PBS,则在含Amp的培养基上不能生长。能在Amp培养基上生长的受体细胞(转化子)肯定已导入了PBS。
质粒转化大肠杆菌的主要有两个用途:1、重组质粒的鉴定。2、为扩增质粒和其它载体作准备。
3材料,试剂与设备
3.1材料
E.coli DH5α菌株: Rˉ,Mˉ,Ampˉ;质粒DNA——实验室提供,eppendorf管。
3.2设备
恒温摇床,电热恒温培养箱,台式高速离心机,无菌工作台,低温冰箱, 恒温水浴锅, 制冰机,微量移液枪。
3.3试剂
1.LB培养基:胰蛋白胨10g/L, 酵母膏提取物5g/L, NaCl 10g/L,琼脂1510g/L, PH=7.4, 121℃ 高压灭菌20min。
2.Amp母液:实验室配制
3.含Amp的LB固体培养基:将配好的LB固体培养基高压灭菌后冷却至60℃左右,加入Amp储存液,使终浓度为50ug/ml,摇匀后涂板。
5.0.05mol/L CaCl2溶液:称取0.28g CaCl2 (无水,分析纯),溶于50ml重蒸水中,定容至100ml,高压灭菌。
4操作步骤
4.1 受体菌的培养
从LB平板上挑取新活化的E.coli DH5α单菌落,接种于3-5ml LB液体培养基中,37℃下振荡培养12小时左右,直至对数生长后期。将该菌悬液以1:100-1:50的比例接种于100ml LB液体培养基中,37℃振荡培养2-3小时至OD600 =0.5左右。
4.2 感受态细胞的制备 (CaCl2法)
1、将培养液转入离心管中,冰上放置10分钟,然后于4℃下3000g离心10分钟。
2、弃去上清,用预冷的0.05mol/L的CaCl2 溶液10ml轻轻悬浮细胞,冰上放置15-30分钟后,4℃下3000g离心10分钟。
3、弃去上清,加入200ul预冷0.05mol/L的CaCl2 溶液,轻轻悬浮细胞,冰上放置几分钟,即成感受态细胞悬液。
4、感受态细胞分装成200μl的小份。
4.3 转化
1、从4℃冰箱中取200μl感受态细胞悬液,立即置冰上。
2、 加入质粒DNA溶液(含量不超过50ng,体积不超过10μl),轻轻摇匀,冰上放置30分钟后。
3、42℃水浴中热击90秒或37℃水浴5分钟,热击后迅速置于冰上冷却3-5分钟。
4、向管中加入1ml LB液体培养基(不含Amp),混匀后37℃振荡培养10—30min,使细菌恢复正常生长状态,并表达质粒编码的抗生素抗性基因(Amp)。
5、将上述菌液摇匀后取15μl 涂布于含Amp的筛选平板上,再用塑料带密封,然后正面向上放置半小时,待菌液完全被培养基吸收后倒置培养皿,37℃培养16-24小时。
同时做两个对照:
对照组1:以同体积的无菌双蒸水代替DNA溶液,其它操作与上面相同。此组正常情况下在含抗生素的LB平板上应没有菌落出现。
对照组2:以同体积的无菌双蒸水代替DNA溶液,但涂板时只取5μl 菌液涂布于不含抗生素的LB平板上,此组在正常情况下应产生大量菌落。
5结果
5.1结果照片如下:
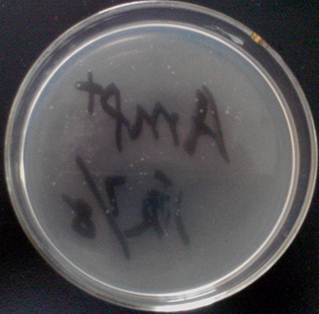
实验组 :Amp+质粒
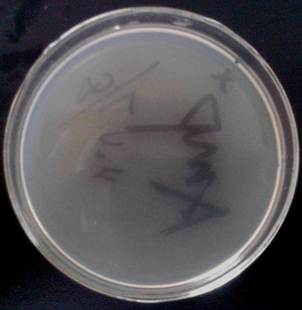
对照组1 :Amp+水

对照组2:水
由上图可知,实验组长了一些菌落,对照组1没有长菌落,对照组2长了大量菌落。
5.2结果分析:
对照组1、2相互对照可知,大肠杆菌原本不能在含有Amp的培养基中生长,而且在不含Amp的培养基中生长得很好。
对照组1与实验组相互对照可知,只有转入质粒的大肠杆菌能够在含有Amp的培养基中生长。
实验组与对照组1、2对照可知,只有很少部分的大肠杆菌转入了质粒,此次实验的转化率比较低。
5.3转化率较低原因分析:
1. 由于在对数中期的大肠杆菌易生成感受态。所以可能是制感受态时受体细胞不再对数中期导致制得的感受态细胞太少,导致转化率很低。
2. 在使用用移液枪的时候注射质粒时过快或者用手混匀的时候用力过大,导致一些受体细胞破裂死亡。
3. 可能是质粒浓度过高,转化的时候进入大肠杆菌内的质粒过多而使大肠杆菌胀破死亡,因而导致转化率降低。
4. 另外,实验操作过程中操作的人过多,染菌的可能性变大使转化率变低。
5.4为了提高转化效率, 实验中要考虑以下几个重要因素:
1) 细胞生长状态和密度。密度不足或过高会使转化率下降。
2) 质粒DNA的质量和浓度。用于转化的质粒DNA应主要是共价闭环DNA。转化率与外源DNA的浓度在一定范围内成正比,量过多货体积过大时,转化率下降。
3) 试剂的质量。
4) 防止杂菌和其他外源DNA的污染。
5) 根据所需质粒DNA的特性,设置相应的选择性培养基进行筛选,有的可能还需进行多补筛选。
6讨论 感受态的制作和质粒转化是分子生物学实验最基本的操作技术。这次实习的一个很重要的目的就是学会这两种技术。结果表明我所操作的实验组转化率较低。而化合物及无机离子对转化率有影响:在Ca2+的基础上,联合其他二价金属离子(如Mn2+,CO2+)、DMSO或还原剂等物质处理细菌,可使转化率提高100~1000倍。所以在以后实验中可以利用这一点对本实验中所用的CaCl2法制备感受态加以改进,以提高转化率。
细菌经0℃ CaCl2处理后转化率随时间的推移而增加,24h达到最高,之后转化率逐渐下降。所以在实验中要用0℃ CaCl2处理大肠杆菌的时间比此次实验中所处理的时间稍作延长,亦可提高转化率。
另外目前制备感受态方法主要有电转化和CaCl2转化法,这两种方法都是目前实验室制备感受态的基本方法。但是它对于我们这样的初学者来说仍略显复杂。最近从网上找到一种更为简捷有效的大肠杆菌感受态细胞制备的方法[1],只需一步室温离心便能够获得与常规方法效价相近,并能够长期保存的大肠杆菌感受态细胞。实验结果显示新方法制备的感受态细胞每微克转化菌落数达 1 0
5---1 06。个,可以满足在质粒中进行的常规克隆需要达到了CaCl2 法的效果。而且所制备的感受态细胞能较长时间 (一8 0℃,至少可保存 9个月) 冷冻保存而转化效率不会下 降, 适于一次大量制备并长期保存使用,这种方法也可以考虑为我所用,简化实验步骤提高转化率。若成熟的话可以在制备感受态细胞时长期使用。
7参考文献:
【1】代红星;张庆桥;樊宝良. 一种简捷有效的大肠杆菌感受态细胞制备方法. 安徽农业科学 20##年第29期
第二篇:电转化大肠杆菌实验
电转化大肠杆菌
所需试剂和器材:
无水乙醇;70%乙醇;双蒸水;感受态细菌(-80℃冰箱);LB培养基;抗生素(根据实验目的选择);1.5ml ep管;电转杯;电转仪 操作步骤:
1. 将电转杯以此用双蒸水、70%要,否则电转杯短路,实验就会失败!),置于空气中充分晾干后,放于冰上;
2. 将待电转DNA与感受态细菌混合,加入电转杯的缝隙处。(除
了腺病毒同源重组外,均使用1mm电转杯)
3. 选择电转仪的Mannul选项,调节电压为1.8KV,按Pulse键进
行电转;用无抗生素的LB培养基500μl冲洗电转杯中细菌,随后转入含抗生素的LB培养基中培养或涂布在抗生素平板上筛选单菌落。
注意事项:
1. 电转杯要充分预冷
2. 在进行腺病毒的重组实验室,要选用2mm内径的电转杯,其它
均使用1mm内径的电转杯。
-
大肠杆菌实验报告
大肠杆菌紫外线诱变及抗药性菌株筛选1.前言抗生素能破坏细菌细胞壁的结构,使细菌的繁殖和生长受到抑制。但某些细菌对抗生素表现出抗性,…
-
大肠杆菌检测实验报告
国标法测定大肠杆菌样本的细菌总数实验目的实验原理国标法操作的原理实验器材培养箱10只移液管1只250ml锥形瓶5只大试管试管架4个…
- 大肠杆菌生长曲线实验报告
-
大肠杆菌实验总结
分离划线分离方法简单但单菌落较难分开涂布分离单菌落更易分开但操作复杂一制备LB培养基通用的细菌培养基1配方蛋白胨100克牛肉膏50…
-
大肠杆菌生长曲线实验报告
广州大学化学化工学院本科学生综合性、设计性实验报告实验课程食品微生物实验实验项目大肠杆菌生长条件的探讨及其生长曲线的测定专业食品科…
-
微生物实验报告:水中细菌总数和大肠菌群的检测
实验六水中细菌总数和大肠菌群的检测摘要本实验以测定公园河流水的细菌总数和大肠菌群的数量来测定特定地点的水质情况初步介绍了一种通用的…
-
大肠杆菌实验报告
大肠杆菌紫外线诱变及抗药性菌株筛选1.前言抗生素能破坏细菌细胞壁的结构,使细菌的繁殖和生长受到抑制。但某些细菌对抗生素表现出抗性,…
-
多管发酵法检测水中的大肠菌群的实验报告
学院环境科学与工程学院班级11级环境科学2班姓名李宝携学号3111007398实验3多管发酵法检测水中的大肠菌群一实验目的1了解饮…
-
生物化学实验报告:Western blotting检测大肠杆菌重组蛋白
实验三Westernblotting检测大肠杆菌重组蛋白一实验目的利用WesternBlotting技术定性或定量检测苦荞黄酮醇合…
-
大肠杆菌检测实验报告
国标法测定大肠杆菌样本的细菌总数实验目的实验原理国标法操作的原理实验器材培养箱10只移液管1只250ml锥形瓶5只大试管试管架4个…
-
重组质粒实验报告
重组质粒的构建转化筛选和鉴定实验目的学习在实现DNA体外重组过程中正确选择合适的载体和限制性内切酶并能对限制性核酸内切酶对载体和目…