大肠杆菌实验报告
大肠杆菌紫外线诱变及抗药性菌株筛选
1.前言
抗生素能破坏细菌细胞壁的结构,使细菌的繁殖和生长受到抑制。但某些细菌对抗生素表现出抗性,原因是其基因发生了改变,产生能抵抗抗生素的性状。在自然情况下,细菌的基因突变率很低,而且突变是不定向的,因此在自然条件下,想要获得有抗性的细菌是很困难的。当给与适当的物理条件时,其突变率会大大增加。如当用α射线、β射线、γ射线、Χ射线、中子和其他粒子、紫外线、微波等物理因素辐射时,能够促进遗传物质突变。DNA 对紫外线(UV)有强烈的吸收作用,尤其是碱基中的嘧啶,它比嘌呤更为敏感。紫外线引起DNA 结构变化的形式有 DNA 链断裂、碱基破坏、胸腺嘧啶二聚体等。因此,紫外线通常作为诱变剂,用于微生物菌种选育。一般细胞分裂越旺盛,诱变剂量越大,突变率高,诱变最有效的波长253~265 nm。选择合适的诱变剂量对于获得较高突变率十分关键,过高或过低的辐射剂量会导致菌株死亡或诱变不充分而降低诱变效果。
在紫外线诱变下,菌株发生不定向的突变,想要得到需要的特向变异必须对诱变后的菌株做筛选。本实验想要得到的是能够抵抗抗生素的菌株,因此可以用抗生素培养基作为筛选培养基对菌种进行筛选。若菌株没有发生定向突变,则该菌株不能在抗性培养基上正常生长,只有发生了定向突变才可能在筛选培养基上正常生长。
紫外线对于菌株有诱变作用外,对菌株还有较强的致死作用,因为紫外线改变了菌株的基因结构导致菌株无法正常生长繁殖。
因此,通过本实验的操作,在合适的照射剂量的设置下,比较不同不同照射剂量下的致死效果和突变率,并初步分析两者的相关性。在分析死亡曲线和诱变率曲线的基础上,能了解诱变育种的机理和方法,为做进一步的诱变实验做准备。
2.材料和方法
2.1实验材料、仪器和试剂
菌种:大肠杆菌
仪器:超净台、离心机、高压灭菌锅、培养箱、磁力搅拌器、培养皿、涂布器、移液管、移液器
试剂:牛肉膏蛋白胨培养基相关试剂、硫酸卡那霉素水溶液(50mg/ml)、生理盐水
2.2实验方法
2.2.1制备培养基
普通培养基——牛肉膏蛋白胨培养基(400ml):
牛肉膏5g 蛋白胨10g Nacl 5g 琼脂20g 蒸馏水1000ml Ph7.0
按配方配制好培养基后置于灭菌锅中115℃ 15min,倒平板,4皿*15ml*5组+2皿*15ml=22皿*15ml=330ml
筛选培养基(200ml):含抗生素50mg/L。(卡那霉素属于氨基糖苷类抗生素,能结合细菌核糖体的30S亚基上的16SrRNA,阻断细菌蛋白质的合成。)
牛肉膏5g 蛋白胨10g Nacl 5g 琼脂20g 蒸馏水1000ml Ph7.0 硫酸卡那霉素水溶液(50mg/ml)0.2ml,按配方先不要加硫酸卡那霉素配制然后115℃ 15min灭菌,取出培养基后冷却至60℃时将硫酸卡那霉素0.2ml加入培养基中,充分震荡混匀,倒平板,2皿*15ml*5组+2皿*15ml=12皿*15ml=180ml
2.2.2制备菌悬液(106 ~ 108个/mL)
①固体培养:大肠杆菌划线或涂布接种于固体培养基,37℃培养24-48h。
②菌悬液:用适量生理盐水刮洗菌落,倒入一个无菌小三角瓶(或试管)中,充分振荡使菌体散开,得到菌悬液。
③菌悬液浓度用血球计数板计数
使用细菌计数板或血球计数板在显微镜下直接计数。将菌液滴在血球计数板0.1ml 的计数格中,细菌被固定染色后,在显微镜下选择数出若干个小格中的细菌数目,(一般数125个小格),根据比例关系折算出单位体积菌液中细菌的数量。
血球计数板规格:
计数格=4*4=16大格
1大格=5*5=25小格
小格体积=0.05*0.05*0.1=0.00025mm3=2.5*10-7ml(长*宽*高)
计算方法例如:125格中90个细菌,则(90÷125)÷(2.5*10-7)个/ml=2.88*106
所以,125格中的细菌大约在31(4格1个菌)—3125(每个小格25个菌)个。
2.2.3诱变处理及接种
① 将紫外灯打开,预热30min;
② 取无菌培养皿(Φ90mm,含无菌大针),加入稀释好的菌悬液8ml以覆盖培养皿底面为宜。
③ 将待处理的培养皿置于诱变箱内的磁力搅拌仪上,开启磁力搅拌仪旋纽进行搅拌1分钟,然后打开皿盖,分别处理10s、20s、40s、80s、160s(可以累积照射),照射完毕后先盖上皿盖,再关闭搅拌和紫外灯;
④ 每个照射剂量分别取0.5ml分别稀释1000倍和100倍,然后取稀释液0.1ml做普通培养基的涂布培养,每个处理两个重复;同时每个照射剂量取0.1ml照射液直接做两个筛选培养基的涂布培养。
⑤ 对照涂布培养:将照射的菌液稀释1000倍,在稀释液中取0.1ml做2个普通培养基涂布培养,2个筛选培养基的涂布培养。涂布要均匀,培养基表面无液流。
⑥ 37℃培养24h后,计数,统计分析。对于筛选的抗性菌种进行验证、纯化。
2.2.4.结果计数、分析、统计及讨论
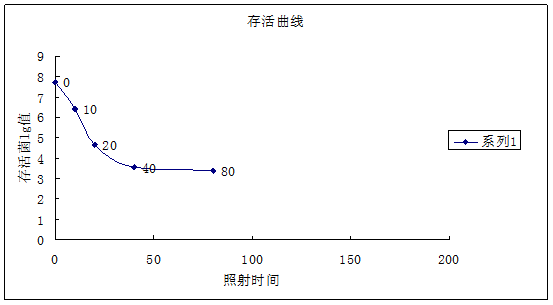
①以辐射时间为横坐标,以存活菌落数的lg值为纵坐标,作紫外线对大肠杆菌致死效应曲线。
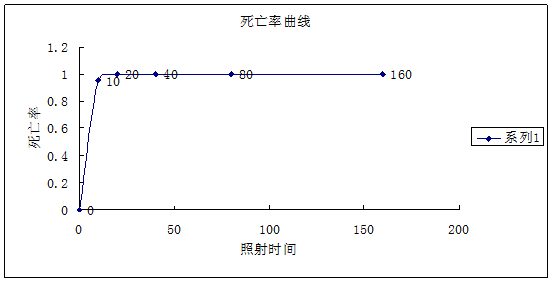
②列公式计算不同辐射剂量下的致死率。


③计算并比较不同辐射剂量下大肠管杆菌的抗药突变率,并分析不同辐射剂量的诱变效果差异原因
突变率=筛选平板菌数/普通平板菌数*100%
④抗药性菌株的筛选与纯化
将一抗性克隆划线到一新的抗性平板上,与对照菌相比较,观察生长状况
3.结果与分析
3.1实验结果记录及初步整理
表1.大肠杆菌诱变初始数据

3.2最佳照射时间的设置
结合数据处理结果的图和表分析,在10s的照射下,细菌死亡率达到了95%,20s时达到了99.9%,说明在20s内大部分菌株已经死亡,而整个实验过程中未发生任何正突变,可能与此有较大关系。已经有实验证实,当菌种死亡率达到70%~80%时,突变率最大。所以在做进一步的实验中应该减少照射剂量,或通过增多10s内的照射设置,或增大照射距离,因为时间太短可能导致控制实验的难度加大。使死亡率变化曲线能突显出变化趋势。
3.3筛选培养基选择
筛选培养基是将发生突变的菌株从普通菌株中显现出来并对其浓缩。该实验中的筛选培养基中的添加剂是硫酸卡那霉素,若发生突变的菌株能对其显现出抗性,但这抗性也是有一定范围的,若超过其抗性范围即使发生突变也不能正常生长。本实验选用的50mg/L,实验证明该浓度对于该菌种抗性选育来说已经过高,应该选择较低的浓度。可以在试验前对该菌种的最低致死浓度做检测。将制备好的出发菌株溶液涂布在含不同浓度硫酸卡那霉素的平板上, 37 ℃培养24h,观察不同平板上的菌落数,并记录不同抗生素作用浓度。凡是在前一个低浓度平板上已长出菌落而在后一个较高浓度平板上未长出菌落的,后一浓度即为某种抗生素对出发菌株的最低致死浓度【1】。
表2.不同照射剂量下的存活率lg值和死亡率

4.小结与讨论
(1)本实验通过对大肠杆菌进行紫外线照射,欲得到抗性菌株,但由于照射剂量过大和抗生素浓度过高等原因未得到任何一株抗性菌株。
(2)通过本实验,得到了在28cm,下大肠杆菌的照射致死致死曲线,可以依此曲线反回归在该照射条件下选择合适的照射时间得到较高的突变率。
(3)欲得到较高的抗性突变率,还可尝试改变培养温度,有实验证实不同的温度培养会对细菌的突变率造成影响【2】。
(4)欲得到较好的突变率还需要较优质的菌株。因为菌株的突变主要是发生在遗传物质复制转录的过程中,所以菌株的生理活性对突变效率会有很大影响,最好选择在对数期的菌株。状况比较同步、易变异、重复性较好;同时为了保证处理时具有一定的细胞浓度,以增加可变异细胞总数,故选用对数期的细胞进行处理。
[1] 涂国全,刘 姝,黎循航. 通过获得链霉菌抗性基因突变株筛选梅岭霉素高产菌株[ J ]. 中国抗生素,2002, 27 (6) : 321 - 325.
[2]汪志芸 抗生素产生菌AP19-1的鉴定及UV诱变育种的研究[D],浙江:浙江大学生命科学学院,2003,29
-
大肠杆菌实验报告
大肠杆菌紫外线诱变及抗药性菌株筛选1.前言抗生素能破坏细菌细胞壁的结构,使细菌的繁殖和生长受到抑制。但某些细菌对抗生素表现出抗性,…
-
大肠杆菌检测实验报告
国标法测定大肠杆菌样本的细菌总数实验目的实验原理国标法操作的原理实验器材培养箱10只移液管1只250ml锥形瓶5只大试管试管架4个…
- 大肠杆菌生长曲线实验报告
-
大肠杆菌实验总结
分离划线分离方法简单但单菌落较难分开涂布分离单菌落更易分开但操作复杂一制备LB培养基通用的细菌培养基1配方蛋白胨100克牛肉膏50…
-
大肠杆菌生长曲线实验报告
广州大学化学化工学院本科学生综合性、设计性实验报告实验课程食品微生物实验实验项目大肠杆菌生长条件的探讨及其生长曲线的测定专业食品科…
-
微生物实验报告:水中细菌总数和大肠菌群的检测
实验六水中细菌总数和大肠菌群的检测摘要本实验以测定公园河流水的细菌总数和大肠菌群的数量来测定特定地点的水质情况初步介绍了一种通用的…
-
FDA大肠菌群和大肠杆菌检测方法
大肠菌群的定义大肠菌群系指一群能发酵乳糖产酸产气需氧和兼性厌氧的革兰氏阴性无芽孢杆菌大肠菌群不是细菌学上的分类命名而是根据卫生学方…
-
多管发酵法检测水中的大肠菌群的实验报告
学院环境科学与工程学院班级11级环境科学2班姓名李宝携学号3111007398实验3多管发酵法检测水中的大肠菌群一实验目的1了解饮…
-
生物化学实验报告:Western blotting检测大肠杆菌重组蛋白
实验三Westernblotting检测大肠杆菌重组蛋白一实验目的利用WesternBlotting技术定性或定量检测苦荞黄酮醇合…
-
大肠菌群_菌落总数检验报告原始记录
微生物实验原始记录粤珍小厨餐饮管理有限公司主检审核检验日期年月日邹平县产品质量监督检验所检验原始记录主检校核检验日期年月日邹平县产…
-
质粒转化大肠杆菌实习报告--附实验图片
细胞转基因技术研究进展1实验内容原核细胞转基因大肠杆菌感受态细胞的制备转化和鉴定2实验原理及技术介绍细菌质粒是一类双链闭环的DNA…