苯甲酸的制备
实验一 苯 甲 酸 的 制 备(共16课时)
本实验以乙醇为起始原料,通过三步反应合成了苯甲酸。其合成路线如下:
1.溴乙烷
在实验室中,饱和烃的一卤衍生物,一般是以醇为原料,使其羟基被卤原子置换而制得的:最常用的方法是以醇与氢卤酸反应:
ROH+HXRX+H2OC2H5C2H5BrC2H5用此法制备溴乙烷、氢溴酸可以用47.5%的浓氢溴酸,也可以借溴化钠和浓硫酸作用的方法制得。其反应式可表示为:
NaBr+H2SO4
CHOH+HBr25HBr+NaHSO4C2H5Br+H2O
上述制备溴乙烷的反应是可逆的,为了使平衡向正反应方向移动,可增加其中一种反应物的浓度或设法使其生成物及时离开反应系统。在本实验中正是这两种措施并用;在增加乙醇用量的同时,把反应中生成的低沸点的溴乙烷及时地从反应混合物中蒸馏出来,以使反应顺利完成。
2.乙苯
在无水三氯化铝等路易斯酸存在下,芳烃与卤代烷作用,发生芳环上的亲电取代反应,生成烷基苯。此反应称弗德—克拉夫茨(Priedd-Crafts)烷基化反应:
在烷基化反应中,由于生成的烷基苯比苯更易于烷基化,因而反应常常难以停止在一烷基化阶段,而常生成多烷基取代物,但烷基化反应是可逆的。如果使用过量较多的芳烃,则可以提高一烷基芳烃的产率,抑制多烷基苯的生成。本实验就是在三氯化铝的催化作用下以溴乙烷和过量的苯反应来制备乙苯的。
主反应:
副反应:
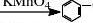
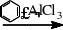
2H5
+C2H5Br+C2H5C2H5+HBr2H5+
2H5
2H52H5C2H5+C2H51
3.苯甲酸
合成芳香酸的方法之一是用碱性高锰酸盐或铬酸溶液来氧化烷基苯。
ArCH2-ArCOOH
用这一方法制备芳酸,则与芳环相连的碳原子上应至少有一个氢原子。否则,氧化反应不能进行。
本实验中,是以上一实验步骤中所制得的乙苯为原料,在碱性条件下,用高锰酸钾将其氧化成为苯甲酸。其反应式为:
COOK+HCl+KClC2H5+KMnO6-+K2CO3+H2O
苯甲酸被用于杀真菌剂,苯甲酸钠是用于食物或软饮料中的主要商品防腐剂。
一、溴乙烷的制备
1.溴乙烷的生成:
在100ml圆底烧瓶中,放入10ml(0.17mol)95%乙醇及9ml水。在不断振荡和冷却下,缓缓加入浓H2SO419ml(0.34mol),混合物冷却至室温,在搅拌下加入研细的溴化钠15g(0.15mol)和几粒。用75°弯管将圆底烧瓶和直型冷凝管连接起来装配成蒸馏装置,接受器内外均应放入冰水混合物,接液管末端应浸没在接受器内液面下。其支管用橡皮管导入下水道或室外。
在石棉网上小火加热烧瓶,使反应平稳发生,约半小时后慢慢加大其火焰,直至无油状物馏出为止。反应结束后,乘热将反应瓶中的硫酸氢钠倒入废液缸中,以免硫酸氢钠冷后结块而不易倒出。
2.溴乙烷的精制:
将馏出液小心地转入分液漏斗中,分出有机层(哪一层),置于干燥的三角烧瓶中,把三角烧瓶浸于冰水浴中,在振摇下逐滴滴加浓硫酸2~3ml,以除去乙醚、乙醇、水等杂质。用干燥的分液漏斗分去酸层(哪一层)。 [5][4][3][2][1]
2
经硫酸处理后的溴乙烷转达入蒸馏烧瓶中,加入沸石,用水浴加热进行蒸馏。用已称重的干燥的三角烧瓶用接受器,三角烧瓶应浸在冰水中。收集35~40℃馏分,测定其产量。
0纯溴 乙烷为无色液体,bp为38.4℃,折光率n21.429。 D
3.溴乙烷的水解及检验溴
在盛有1~2ml 5%NaoH溶液的试管中,加入1~2滴溴乙烷。用小火加热,加热时要使加热部位由液面开始逐渐下移至管底,同时不断摇荡试管。待反应后放置冷却,取出一部分溶液倒入另一试管内,再用6mol·L-1HNO3中残碱,使硝酸达到过量的程度。然后再加入几滴2% AgNO3,则有黄色沉淀生成。
注 释
[1]加少量的水可防止反应进行时反生大量泡沫,减少副反应的发生和避免氢溴酸的挥发。
[2]溴化钠应预先研细,并在搅拌加入,以防结块而影响氢溴酸的产生。
[3]溴乙烷在水中的溶解度很小(1:10),在低温时又不与水作用,为什么减少其发挥,常在接受器内预盛冷水,并使接液管稍微浸入水中。
[4]蒸馏速度宜慢,否则蒸汽来不及冷凝而逸失,而且在开始加热时,常有很多泡沫发生,若加热太剧烈,会使反应物冲出。
[5]尽可能地将水分净,否则用浓硫酸洗涤时会产生热量而使产物挥发。
思考题:
1.本实验中存在有哪些副反应?在操作中采取了哪些措施来减少副反应的发生?
2.本实验中,哪一种原料是过量的?为什么反应物间的配比值不是1:1?在计算产率时,选用何种原料作为根据?
3.反应开始时,反应瓶中往往出现红棕色,为什么?纯净的溴乙烷是无色的,而制得的溴乙烷可能呈黄色,为什么?如何消除这种黄色?
3
二、乙苯的制备
在125ml三颈烧瓶的三个口上分别装上温度计、回流冷凝管和恒压漏斗,冷凝管的上中装有氯化钙干燥管,并连有易溶于水的有害气体吸收装置。
在三颈烧瓶中迅速加入粉状的无水三氯化铝1.5~2g,与溴乙烷的体积比为3:1的苯。在恒压漏斗中加入新蒸馏的溴乙烷(与苯的体积比为1:3)。把整个装置装在电动搅拌器上。检查全部装置装好后,开动电动搅拌器,在不断搅拌下慢慢滴加溴乙烷,当观察到有溴化氢气体逸出,并有不溶于苯的棕红色络合物生成时,表明反应已经开始,此时,应立即减慢加料速度,避免反应过于剧烈。
加料完毕后,继续搅拌,当反应缓和下来时,开动加热器加热,使反应物的温度逐渐升至55~60℃,维持在此温度下反应1小时。停止搅拌,用冷水冷却。
待反应物充分冷却后,在通风橱中,在不断搅拌下将反应物缓慢地倒入预配好50kg冰、50ml水及6ml浓盐酸的烧杯中进行水解。在分液漏斗中分出水层,烃层用约等体积的水洗涤2次,分出烃层,用约2g无水氯化钙干燥。
将粗产品转入100ml干燥的圆底烧瓶中。用两球分馏柱进行分馏,用多头接受器收集85℃以前的馏分(回收),再收132~139℃的馏分,得产品,测定其产量。
00纯乙苯为无色透明液体,bp:136.3℃,d2:0.8669折光率n2:1.4959。 4D
注 释
[1]所用的仪器或药品不干燥,将严重影响实验效果,甚至使实验失败。
[2]无水三氯化铝曝露在空气中,极易吸水分解而失效。应当用新升华过的或装备严密的试剂,称取时动作要迅速,取用后也应尽快盖好试剂瓶。块状的无水三氯化铝在称取前需在研体中迅速地研细。
思考题:
1.做本实验时特别需要注意什么问题?
2.为什么本实验中苯的量大大超过了理论量?如果将苯的用量减少,会产生什么结果?
3.反应完毕后,为什么要将混合物倒入稀盐酸中?为什么要用冰水?
4.分离产品时,为什么采用分馏法把苯分离出来?将干燥过的粗产品直接进行蒸馏有什么不好?
4
三、苯甲酸的制备
在装有回流冷凝管的250ml圆底烧瓶中放入150ml水,物质的量之比为1:4.5的乙苯和高锰酸钾,然后再按每摩尔乙苯100ml的量加入3mol/L的氢氧化钠溶液。缓缓加热回流,直到乙苯层几乎近于消失,回流液不再出现油珠(约3~4h)。
为了检查溶液中未变化的高锰酸盐,可取一滴反应混合液点在滤纸上,若在二氧化锰棕色斑点外沿有紫色圈,说明尚有高锰酸盐。向混合物中加少量的固体亚硫酸氢钠以破坏过量的高锰酸盐,直至实验呈阴性。切勿把亚硫氢钠加得太多。然后在热溶液中加入1~2g活性碳,趁热减压过滤,用少量的热水洗涤反应瓶及滤瓶。合并滤液及洗涤,将其浓缩至一半的体积。放冷后,用浓盐酸酸化至刚果红试纸变蓝,混合物置于冰水浴中冷却至苯甲酸全部析出。抽气过滤收集苯甲酸,用少量的冷水洗涤。粗产品用热水重结晶一次,用蒸气浴于干燥,测定其产量。
纯苯甲酸为无色针状晶体,mp:122.4℃。
注 释
[1]开始加热时一定要控制加速度,加热过烈会引起严重暴沸。
[2]活性碳是起助滤剂的作用,为了防止二氧化锰细粉堵塞滤纸孔,帮助过滤顺利进行。
[3]苯甲酸在某些温度下在100ml水中的溶解度为:4℃、0.18g;18℃、0.27g;75℃、2.2g;
思考题:
1.写出在碱性条件下乙苯和高锰酸盐反应生成苯甲酸和二氧化锰的化学方程式;
2.在本实验中,影响苯甲酸产量的主要因素有哪些?
5
第二篇:苯甲酸制备实验装置操作说明
甲苯空气氧化制苯甲酸实验装置说明
一、 前言
本装置为塔式鼓泡反应器和玻璃精馏塔组成一套完整的苯甲酸制备实训装置,塔式设备广泛用于气液相反应或气液固相反应。它是一个非均相反应过程,气体可为一种或多种类型,而液体可以为反应物或催化剂,其反应速度决定化学反应速度和两界面上组分分子扩散速度,充分接触是加快反应的必要条件,实验室常用该反应器做有机化合物氧化,如烷烃氧化制有机酸、对二甲苯氧化生成对苯二甲酸、环已烷氧化生成环己醇和环已酮、乙醛氧化制乙酸、乙烯氧化制乙醛、苯氯化制氯苯、甲苯氯化制氯甲苯、乙烯氯化制氯乙烯、烯烃加氢、脂肪酯加氢等。此外,还可进行SO3、NO2、CO2、H2S的吸收反应、生化反应、污水处理等。
采用鼓泡氧化反应器的原因是:
(1)进气体能以小气泡形式分布,可连续不断进入保证气液接触反应效果良好;
(2)反应器结构简单,容易稳定操作;
(3)有较高的传质、传热效率,适于慢反应和强放热反应;
(4)换热件安装方便。可处理悬浮液体,塔内可填加构件;
采用精馏塔分离的原因是:
(1)从苯甲酸与甲苯混合液中分离回收甲苯;
(2)从粗苯甲酸溶液中提纯苯甲酸。
采用分相器的原因是:
氧化反应会产生一些水,水会影响甲苯转化,故必须排水,排水过程甲苯也会排出,用分相器可使甲苯与水分离。
二、 技术指标
1、 最高操作压力0.6MPa,使用温度170℃。
2、 甲苯氧化反应器,下段φ57×4mm,高度440mm,外加套76mm,内插加热管φ10×1.5mm;上段φ89×4mm,外加套108mm,高度150mm。气体分布器开孔率10%。
3、 转子流量计N2 0.1—10L/min、O2 0.2—20L/min。
4、 热液体循环齿轮泵30L/hr。
5、 无油空压机 1000L/hr。
6、 导热油加热器25—150℃。
7、 甲苯加料电磁泵 0.79L/hr。
8、 精馏塔釜1L,电热包加热功率400w、精馏塔直径20mm,塔高1400mm, 塔外壁有两段透明膜导电加热保温,加热功率各200w。
9、 摆锤式内回流塔头,回流比控制0—99秒内自动控制。
10、 甲苯加料罐。
三、 装置面板布置及流程示意图
1、面板布置图

2、流程示意图

3、反应器装配图
四、 操作说明
1. 准备工作
(1)将液体甲苯注入储罐内,并接好进气管线N2与空气,将气体、液体出口阀门关死,通入N2或空气在0.6MPa下试漏,十分钟内压力不变为合格,可以进料,并通入气体鼓泡,当液体加至在溢流口内有流出时,可加入催化剂,同时将恒温水浴升温至所需温度,可进行间歇反应。
(2)操作时将循环泵开动起来,调节变频调速装置,使循环量达到所需要求。连续进出物料时,反应须用泵进料,气体流量控制在20ml/min左右,液体加料要求要根据选定的停留时间而定,高转化须调低进料速度,但选择性要降低些;高液空速加料会使转化率下降,但选择性能够提高。
实验中要不断在溢流口调节阀门的开度,以排除反应后的液体,可保持鼓泡器内液位稳定。反应压力一旦确定,就不要随意改变系统压力,压力变化会造成,排料数据不能稳定。一般来说:在一开始就调节好进气压力和出气压力,此后只能为微调动各阀门,不应该大起大落的调节。
当试验完成后继续通气反应一定时间,最后通N2清扫,并放出所有反应液,用清水充满鼓泡器,清洗干净,以防腐蚀生锈。
实验中应注意安全问题、避免空气与原料气浓度进入爆炸极限内,时刻用N2进行调整。
当反应产物有一定数量时,可开启精馏塔。渐渐升温是塔顶温度达到110℃。收集甲苯原料,塔底产物用重结晶的方法处理得到纯苯甲酸。或者用多次累积量再精馏,控制塔底温度190℃,塔顶温度160℃,留出物为苯甲酸纯品。
五、 停车操作
当反应结束后停止加料(液体),停止加热,关闭电源。电源关闭后要继续通气,待温度降至50℃以下可关闭气体(具体视催化剂的要求而定)。
精馏设备可用甲苯洗涤。塔底产物为催化剂与碳化物用其他溶剂稀释做废物处理。
六、故障处理
1、开启电源开关指示灯不亮,并且没有交流接触器吸合声,则保险坏或电源线没有接好。
2、开启仪表各开关时指示灯不亮,并且没有继电器吸合声,则分保险坏或接线有脱落的地方。
3、开启电源开关有强烈的交流震动声,则是接触器接触不良,应反复按动开关可消除。
4、仪表正常但仪表数值没有变化,可能保险坏或固态变压或固态继电器坏。
5、控温仪表、显示仪表出现四位数字,则告知热电偶有断路现象。
6、反应系统压力突然下降,则有大泄露点,应停车检查。
7、电路时通时断,有接触不良的地方。
8、压力增高,尾气流量减少,系统有堵塞的地方,应停车检查。
-
苯甲醇和苯甲酸的制备
南昌大学有机化学实验报告学生姓名小田田学号专业班级实验类型验证综合设计创新实验日期20xx年4月24日实验地点同组学生姓名指导教师…
-
实验十苯甲醇和苯甲酸的制备
实验十苯甲醇和苯甲酸的制备一实验目的1学习由苯甲醛制备苯甲醇和苯甲酸的原理和方法2进一步熟悉机械搅拌器的使用3进一步掌握萃取洗涤蒸…
-
苯甲醇和苯甲酸的制备
苯甲醇和苯甲酸的制备185本实验根据什么原理来分离纯化苯甲醇和苯甲酸这两种产物的答根据苯甲酸钠苯甲醇在水中和在乙醚中的溶解度不同苯…
-
苯甲醇和苯甲酸的制备预习报告及思考题
苯甲醇和苯甲酸的制备一实验目的1学习由苯甲醛制备苯甲醇和苯甲酸的原理和方法2巩固机械搅拌器的使用3进一步掌握萃取洗涤蒸馏干燥和重结…
-
实验化学 实验六 苯甲醇和苯甲酸的合成
实验化学刘晓庚实验六苯甲醇和苯甲酸的合成一实验目的1掌握坎尼查罗反应的原理和方法2了解苯甲醇和苯甲酸的其他制备方法3了解苯甲醇和苯…
-
团建工作总结
汕头海关20xx年团建工作总结20xx年,汕头海关团委以邓小平理论、“三个代表”重要思想和党的十六届四中全会精神为指导,紧紧围绕总…
-
期中总结
中捷小学期中工作总结(20xx-20xx学年度第一学期)半学期的教育教学工作在紧张繁忙中结束。回顾半学期的教学工作,有得有失。现将…
-
南桥中学刘波远程培训总结
暑期远程教育培训总结参加本次教师远程培训,收获不少。一、远程教育培训使我懂得学习的重要性教书育人,教师自身的贮备和素质很重要。教师…
-
20xx年大学生村官社区工作总结
工作总结转眼之间,我的村官生涯已近一年,这一年里,在组织的关怀,领导的关心,同事的帮助下,我思想有提高,工作有进步,同时我也积极参…
-
煤矿技术员个人总结_-个人工作总结
我叫x,***x年x月结业于x理工大学x工程及其x专业,同时取得工学学士学位,200x年x月加进x。通过到场团体公司在学校组织的社…