离子迁移数的测定
实验十 离子迁移数的测定
【目的要求】
1.掌握希托夫法测定电解质溶液中离子迁移数的某本原理和操作方法。
2.测定CuSO4溶液中Cu2+和SO42-的迁移数。
【实验原理】
当电流通过电解质溶液时,溶液中的正负离子各自向阴、阳两极迁移,由于各种离子的迁移速度不同,各自所带过去的电量也必然不同。每种离子所带过去的电量与通过溶液的总电量之比,称为该离子在此溶液中的迁移数。若正负离子传递电量分别为q+和q-,通过溶液的总电量为Q, 则正负离子的迁移数分别为:
t+=q+/Q t-=q-/Q
离子迁移数与浓度、温度、溶剂的性质有关,增加某种离子的浓度则该离子传递电量的百分数增加,离子迁移数也相应增加;温度改变,离子迁移数也会发生变化,但温度升高正负离子的迁移数差别较小;同一种离子在不同电解质中迁移数是不同的。
离子迁移数可以直接测定,方法有希托夫法、界面移动法和电动势法等。
用希托夫法测定CuSO4溶液中Cu2+和SO42-的迁移数时,在溶液中间区浓度不变的条件下,分析通电前原溶液及通电后阳极区(或阴极区)溶液的浓度,比较等重量溶剂所含MA的量,可计算出通电后迁移出阳极区(或阴极区)的MA的量。通过溶液的总电量Q由串联在电路中的电量计测定。可算出t+和t-。
在迁移管中,两电极均为Cu电极。其中放CuSO4溶液。通电时,溶液中的Cu2+在阴极上发生还原,而在阳极上金属银溶解生成Cu2+。因此,通电时一方面阳极区有Cu2+迁移出,另一方面电极上Cu溶解生成Cu2+,因而有
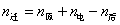
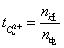 ,
,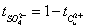
式中n迁表示迁移出阳极区的电荷的量,n原表示通电前阳极区所含电荷的量,n后表示通电后阳极区所含Cu2+的量。n电用表示通电时阳极上Cu溶解(转变为Cu2+)的量也等于铜电量计阴极上析出铜的量的2倍,可以看出希托夫法测定离子的迁移数至少包括两个假定:
(1)电的输送者只是电解质的离子,溶剂水不导电,这一点与实际情况接近。
(2)不考虑离子水化现象。
实际上正、负离子所带水量不一定相同,因此电极区电解质浓度的改变,部分是由于水迁移所引起的,这种不考虑离子水化现象所测得的迁移数称为希托夫迁移数。
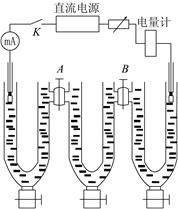
图2-15-2 希托夫法测定离子迁移数装置图
【仪器试剂】
迁移管1套; 铜电极2只; 离子迁移数测定仪1台; 铜电量计1台; 分析天平1台;台秤1台;移液管(20mL)3只;
H2SO4(2mol.L-1); 硫酸铜溶液(0.05mol。L-1);HCl(4mol.L-1)
【实验步骤】
1.水洗干净迁移管,然后用0.05mol/L的CuSO4溶液洗净迁移管,并安装到迁移管固定架上。电极表面有氧化层用细砂纸打磨。
2.将铜电量计中阴极铜片取下,先用细砂纸磨光,除去表面氧化层,用蒸馏水洗净,用乙醇淋洗并吹干,在分析天平上称重,装入电量计中。
3.连接好迁移管,离子迁移数测定仪和铜电量计(注意铜电量计中的阴、阳极切勿接错)。
4.接通电源,按下“稳流”键,调节电流强度为20mA,连续通电90min。
7.停止通电后,迅速取阴、阳极区溶液以及中间区溶液称重,滴定(从迁移管中取溶液时电极需要稍稍打开,尽量不要搅动溶液,阴极区和阳极区的溶液需要同时放出,防止中间区溶液的浓度改变)。
【注意事项】
1.实验中的铜电极必须是纯度为99。999%的电解铜。
2.实验过程中凡是能引起溶液扩散,搅动等因素必须避免。电极阴、阳极的位置能对调,迁移数管及电极不能有气泡,两极上的电流密度不能太大。
3.本实验中各部分的划分应正确,不能将阳极区与阴极区的溶液错划入中部,这样会引起实验误差。
4.本实验由铜库仑计的增重计算电量,因此称量及前处理都很重要,需仔细进行。
【数据处理】
温度:开始: 24.3 ℃ 大气压:101.9kpa
终了; 24.2 ℃
平均:24.25 ℃
Ccuso4=0.0521 mol/l Mcu=63.5g/mol Mcuso4=159.5g

由电量计中铜电极质量增加,计算n电
n电=2(W2-W1)/Mcu=[2(10.3468-0.3436)/63.5]=1.0079l*10^(-3)mol
有阳极区的溶液得n后
V2=25.00(后)*W2后/W(25后)=25.00*39.7628/25.1105=35..5878ml
n后=Ccuso4(后)V2/1000=【0.0594*39.5878/1000]=2.3515*10^(-3)mol
由原硫酸铜溶液得n原
V1=25.00(原)*W2原/W(25原)=25.00*39.7142/25.0842=39.5809ml
n原=Ccuso4(原)*V1/1000=0.0521*39.5809/1000=2.0622*10^(-3)mol 所以 n迁=n电+n原—n后=1.0079l*10^(-3)+2.0622*10^(-3)-2.3515*10^(-3)=0.71861*10^(-3)mol
t(cu2+)=n迁/n电= 0.71861*10^(-3)/ 1.0079l*10^(-3)=0.71
t(so42-) =1-t(cu2+)= 1- 0.71=0.29
铜片的增量/铜的原子量=n电
5.计算阴极区离子的迁移数,与阳极区的计算结果进行比较,分析。
阳极部得到: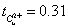 ;
;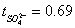
阴极部得到: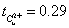 ;
;
思 考 题
1.通过电量计阴极的电流密度为什么不能太大?
2.通过电前后中部区溶液的浓度改变,须重做实验,为什么?
3.0。1mol.L-1KCl和0。1 mol.L-1NaCl中的Cl-迁移数是否相同?
4.如以阳极区电解质溶液的浓度计算t(Cu2+),应如何进行?
第二篇:离子迁移数测定
离子迁移数测定
一 实验目的
掌握界面移动法测定H+ 离子移数的基本原来和方法,通过求算H+离子的电迁移率,加深对电解质溶液有关概念的理解。
二 实验原理
电解质溶液的导电是靠溶液内的离子定向迁移和电极反应来实现的。而通过溶液的总电量Q就是向两极迁移的阴、阳离子所输送电量的总和。现设两种离子输送的电量分别为Q+、Q-,则总电量 Q = Q+ + Q -= I t (2-124)
为了表示每一种离子对总电量的贡献,令离子迁移数为t+与t-, 则:
QQt+=+,t?=? QQ
(2-125)
离子的迁移数与离子的迁移速度有关,而
后者与溶液中的电位梯度有关。为了比较离子
的迁移速度,引入离子电迁移率概念。它的物
理意义为:当溶液中电位梯度为1Vxm时的
?1?1式中I为电流强度,t为通电时间。 离子迁移速度,用u+、u- 表示,单位为mxs
xV 。
本实验采用界面移动法测定HCl溶液中
H离子的迁移数,其原理如图2-58所示。在
一根垂直安置的有体积刻度的玻璃管中,装入
含甲基橙指示剂的HCl溶液,顶部插入Pt丝
作阴极,底部插入Cd极作阳极。通电后,H
? + + ?12 图2-58 迁移管中离子迁移示意图
2+ 离子向Pt极迁移,放出氢气,Cl离子向Cd极迁移,且在底部与由Cd电极氧化而生成的Cd
逐步替代HCl溶液。由于Cd2+ +

离子形成CdCl2溶液,离子的电迁移率小于H离子,所以底部
的Cd2+ 离子总是跟在H离子后面向上迁移。因为CdCl2与HCl对指示
++ 剂呈现不同的颜色,因此在迁移管内形成了一个鲜明的界面。下层Cd
子迁移的平均速度。
+ 若溶液中H离子浓度为c2+ 离子层为黄色,上层H 离子层为红色。这个界面移动的速度即为H+ 离H+,实验测得t时间内界面从1-1到2-2
+ 移动过的相应体积为V,则根据式(2-124)与式(2-125),H离子的迁移
数为 tH+=cH+VF
It
?1 (2-126) 式中F为法拉第常数,96 485Cxmol。
应该指出,由于迁移管内任一位置都是电中性的,所以当下层的H离子迁移后即由Cd
Cd
2+ + 2+ 离子来补充。这样,稳定界面的存在意味着+ 离子的迁移速度与H离子的迁移速度相等。即 ?dE??dE???? (2-127) =u2+?uCd?dl?2+H+?dl?+??Cd层??H层
?dE?式中??dl??为迁移管内的电位梯度,即单位长度上的电位降。
??
?dE??dE???所以?因为离子电迁移率不同,u2+<u+,>?dl?2+?dl??+。CdH??Cd层??H层
此式表明Cd
的Cd2+ 2+ 离子层电位梯度比H离子层大,也即Cd+ + + 2+ 离子层单位长度的电阻较大。因此,若在下层有H离子,其迁移速度不仅比同层离子快,而且要比处在上层的H离子也快,它总能赶到上层去。
2+ 反之,超前的Cd离子也必会减慢迁移速度而到下层来。这样,形成
+ 2+ 并保持了稳定的界面。同时,随着界面上移,H离子浓度减小,Cd离
子浓度增加,迁移管内溶液电阻不断增大,整个回路的电流会逐渐下降。
通过离子迁移数的测定,用下式可求得离子的电迁移率: tΛmtΛm ,u?=? (2-128) u+=+
FF
式中Λm为一定温度下溶液的摩尔电导率,单位为S?m2?mol?1。
三 试剂与仪器
试剂:0.1molxL?1 HCl标准
溶液,0.1%的甲基橙指示剂,
Cd棒(φ 3×30 mm),Pt丝。
仪器:带恒温水夹套迁移
管,300V直流电源,100?标准
电阻,毫安表,数字电压表,秒
表。
仪器装置见图2-59。
四 实验步骤
1. 用去离子水与待测液先
后淋洗迁移管的内壁,注入含甲
基橙指示剂的浓度为0.1molxL?1
图2-59 界面移动法实验装置 的HCl标准溶液(其体积比为:
指示剂:酸= 5:100)。通恒温水使系统恒温于25.0 ± 0.1℃。
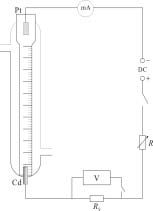
2. 按图2-59接好线路。图中V表为数字电压表,Rs为标准电阻,R为可变电阻,DC为直流电源。控制直流电源输出电压为300V,调节电阻R,使电流控制在3 mA左右。(注意:高压直流电危险!)
3. 待迁移管内界面移动到0.2 mL时开始计时,界面每移过0.02 mL记录相应的时间和数字电压表读数。直至界面移动到0.5 mL为止。 五 数据处理
1. 由测得电压U及标准电阻R s,求得电流I=U,以此电流Ι对Rs
相应的时间t作图,如图2-60所示,求出其包围的面积即总电量I t。如为直线,可按梯形法求出面积。
2. 用与总电量I t对应的界面移过的体积V,代入式(2-126)求得tH+。
3. 已知25.0℃时0.1molxL
2?1?1 HCl溶液的摩尔电导率为0.03
913Sxmxmol,根据式(2-128)计算
H+ 离子的迁移率。
4. 考虑到迁移管的体积未经校
正以及电源电压的波动,可以取不
同间隔的体积V及对应的电It,分
别求得t+,再取平均值。 H
图2-60 I-t积分图 六 思考题
+ 1. 为什么在迁移过程中会得到一个稳定界面?为什么界面移动速度就是H离子移动速度?
2. 如何能得到一个清晰的移动界面?
3. 实验过程中电流值为什么会逐渐减小?
4. 如何求得Cl离子的迁移数? ?
实验指导参考
一、教学要点
1、迁移数概念。
2、迁移管中为什么会形成一个鲜明的界面?而且会是一个稳定的界面?
3、分析界面移动速度即H+离子迁移的平均速度。
4、随着界面向上移动,整个回路电流逐渐下降的原因。 5、I~t积分图的测求。
二、指导实验的要点
1、迁移管内不可有气泡。
2、为获得稳定的界面,防止管内两层液体间对流、扩散,电流不宜过高,应控制在3mA左右。
3、正确使用标准电阻。
三、数据处理示例
25℃ cHCl=0.1015 molxL?1, 迁移体积 V = 0.32cm3 I~t 积分图上得 I × t=3.81 Axs
+ tH= cH+VF/(I×t) = 0.1015×0.32×10?3×96485/3.81=0.82
uH+= tH+Λm /F = 0.82×0.03913/96485 = 3.33×10?7 m2S?1V?1
四、思考题解答要点
1、参见实验原理部分。
。 2、参见“进一步讨论”
3、由于H + 离子浓度减小,Cd 2+ 离子增大,迁移管内溶液的电阻不断增大,使回路的电流值逐渐减小。
4、Cl ? 离子的迁移数与H + 离子的迁移数之和为1。
五、进一步讨论
1. 界面移动法的关键是要形成一个鲜明的移动界面,为达此目的,必须:
2+ ① 选择适当的指示离子。如本实验选用Cd离子因为uCd2+<uH+,
使上下两层分开而不相混。
② 防止迁移管内两层间的对流和扩散。所以迁移管内温度应该均匀,且温度不宜过高;通过的电流不宜过大;迁移管截面积要小;实验时间不宜过长。
③ 选择最合适的指示剂,使两层的颜色反差明显。
2. 影响离子迁移数的因素主要是电解质溶液的浓度与温度。温度升高,正、负离子迁移数的差值减小。浓度的影响,考虑到离子间的相互作用力,故难有普遍规律。
3. 测定离子迁移数除界面移动法外,还有希脱夫(Hittorf)法。它是根据电解前后在两电极区由于离子迁移与电极反应导致极区溶液浓度的变化。此法适用面较广,但要配置库仑计及繁多的溶液浓度分析工作。
-
离子迁移数的测定实验报告
离子迁移数的测定界面法姓名学号班级同组实验者实验日期提交报告日期实验助教1引言11实验目的1采用界面法测定H离子的迁移数2掌握测定…
-
离子迁移数的测定实验报告
离子迁移数的测定界面法姓名张腾学号20xx011864班级化21同组实验者田雨禾实验日期20xx年12月4日提交报告日期20xx年…
- 离子迁移数的测定实验报告
-
18 离子迁移数的测定
实验十八离子迁移数的测定一实验目的1加深理解迁移数的基本概念2用希托夫法和界面移动法分别测定H2SO4水溶液和HCl水溶液中离子迁…
-
离子迁移数的测定
实验十五离子迁移数的测定当电流通过电解质溶液时溶液中的正负离子各自向阴阳两极迁移由于各种离子的迁移速度不同各自所带过去的电量也必然…
- 电池电动势及温度系数的测定-实验报告(四川理工学院)
-
大学物理化学实验报告-化学电池温度系数的测定
物理化学实验报告院系化学化工学院班级学号姓名实验名称化学电池温度系数的测定日期同组者姓名室温1960气压1020kPa成绩一目的和…
-
蔗糖水解反应速率常数的测定实验报告
序号6物理化学实验报告姓名院系化学化工学院班级学号指导老师同组者实验项目名称蔗糖水解反应速率常数的测定一实验目的1根据物质的旋光性…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
蔗糖水解反应速率常数的测定实验报告
蔗糖水解反应速率常数的测定一实验目的1根据物质的旋光性质研究蔗糖水解反应测定蔗糖转化反应的速率常数和半衰期2了解该反应的反应物浓度…