实验十四 水中总大肠杆菌的测定
实验十四 水中总大肠杆菌的测定
1 原理
总大肠杆菌群可用多管发酵法或滤膜法检测。多管发酵法的原理是根据大肠菌群细菌能发酵乳糖,产酸产气以及具备革兰氏染色阴性,无芽孢,呈杆状等有关特性,通过三个步骤进行检验,求得水样中的总大肠菌群数,实验结果以最可能数(most probable number),简称MPN表示。
2 仪器
2.1 高压蒸汽灭菌器。
2.2 恒温培养箱,冰箱。
2.3 生物显微镜,载玻片。
2.4 酒精灯,镍铬丝接种棒。
2.5 培养皿(直径100mm),试管(5×150mm),小倒管,吸管(1,5,10ml),烧杯(200,500,2000ml),锥形瓶(500,1000ml),采样瓶。
3 培养基及染色剂的制备
3.1 乳糖蛋白胨培养液:
将10g蛋白胨、3g牛肉浸膏、3g乳糖和5g氯化钠加热溶于1000mL蒸馏水中,调节pH为7.2-7.4,再加入1.6%溴甲酚紫乙醇溶液1mL,充分混匀,分装于试管(内有倒管)中,于121℃高压灭菌器中灭菌15min,贮存于冷暗处备用。
3.2 三倍浓缩蛋白胨溶液:
按上述乳糖蛋白胨培养液的制备方法制备。除蒸馏水外,各组分用量增加至三倍。
3.3 品红亚硫酸钠培养基
3.3.1 贮备培养基的制备
于2000mL烧杯中,先将20-30g琼脂加到900mL蒸馏水中,加热溶解,然后加入
3.5g磷酸氢二钾及10g蛋白胨,混匀,使其溶解,再用蒸馏水补充到1000mL调节溶液pH至7.2-7.4。趁热用脱脂棉或绒布过滤,再加10g乳糖,混匀,定量分装于250或500mL
46
锥形瓶内,置于高压灭菌器中,在121℃灭菌15min,贮存与冷暗处备用。
3.3.2 平皿培养基的制备
将上法制备的贮备培养基加热融化。根据锥形瓶内培养基的容量,用灭菌吸管按1:50比例吸取5%碱性品红乙醇溶液,置于灭菌空试管中;再按1:200比例称取无水亚硫酸钠,置于另一灭菌空试管内,加灭菌水少许使其溶解,再置于沸水浴中煮沸10min(灭菌)。用灭菌吸管吸取已灭菌的亚硫酸钠溶液,滴加于碱性品红乙醇溶液内至深红色再褪至淡红色为止(不宜加多)。将此混合液全部加入已融化的贮备培养基内,并充分混匀(防止产生气泡)。立即将此培养基适量(约15mL)倾入已灭菌的平皿内,再冷却凝固后置于冰箱内备用,但保存时间不宜超过2周。如培养基由淡红色变成深红色则不能再用。
3.4 伊红美蓝培养基制备
于2000mL烧杯中,先将20g琼脂加到900mL蒸馏水中,加热溶解,再加入2g磷酸二氢钾及10g蛋白胨,混合使之溶解,用蒸馏水补充至1000mL,调节溶液pH值至7.2-7.4,趁热用脱脂棉或绒布过滤,加入2%伊红水溶液(0.4g伊红溶于20mL水中)20ml和0.5%美蓝水溶液(0.065g美蓝溶于13mL水中)13ml,再加入10g乳糖,混匀后定量分装于250或500mL锥形瓶内,于121℃高压灭菌15min,放冷至45℃左右,无菌操作下将此培养基适量倾入已灭菌的空平皿内,待冷却凝固后,置于冰箱内备用。
3.5 革兰氏染色剂
3.5.1 结晶紫染色液:
将20mL结晶紫乙醇饱和溶液(称取4-8g结晶紫溶于100mL95%乙醇中)和80mL1%草酸铵溶液混合并过滤。该溶液放置过久会产生沉淀,不能再用。
3.5.2 助染剂:
将1g碘与2g碘化钾混合后,加入少许蒸馏水,充分振荡,待完全溶解后,用蒸馏水补充至300mL。此溶液2周内有效。当溶液由棕黄色变为淡黄色时应弃去。为易于贮备,可将上述碘与碘化钾溶于30mL蒸馏水中,临用前再加水稀释。
3.5.3 脱色剂:95%乙醇。
3.5.4 复染剂:将0.25g沙黄加到10mL95%乙醇中待完全溶解后,加90mL蒸馏水。 4 测定步骤
47
4.1 生活饮用水
4.1.1 初发酵实验:在两个装有已灭菌的50mL三倍浓缩乳糖蛋白胨培养液的大试管或烧瓶中(内有倒管),以无菌操作加入充分混匀的水样10mL,混匀后置于37℃恒温箱内培养24h。
4.1.2 平板分离:上述各发酵管经培养24h后,将产酸,产气及只产酸的发酵管分别接种于伊红美蓝培养基或品红亚硫酸钠培养基上,置于37℃培养箱内培养24h,挑选符合下列特征的菌落。
a.伊红美蓝培养基上:深紫黑色,具有金属光泽的菌落;紫黑色,不带或略带金属光泽的菌落:淡紫红色,中心色较深的菌落。
b.品红亚硫酸钠培养基上:紫红色,具有金属光泽的菌落;深红色,不带或略带金属光泽的菌落;淡红色,中心颜色较深的菌落。
4.1.3 取有上述特特征的群落进行革兰氏染色
a、 用已培养18-24h的培养物涂片,涂层要薄。
b、 将涂片在火焰上加温固定,待冷却后滴加结晶紫溶液,1min后用水洗去。 c、 滴加助染剂,1min后用水洗去。
d、 滴加脱色剂,摇动玻片,直至无紫色脱落为止(约20-30s),用水洗去。 e、 滴加复染剂,1min后用水洗去,晾干、镜检,呈紫色者为革兰氏阳性菌,呈红
色者为阴性菌。
4、 复发酵实验:上述涂片镜检的菌落如为革兰氏阴性无芽孢的杆菌,则挑选该菌落的另一部分接种于装有普通浓度乳糖蛋白胨培养液的试管中(内有倒管),每管可接种分离自同一初发酵管(瓶)的最典型菌落1-3个,然后置于37℃恒温箱中培养24h,有产酸、产气者(不论倒管内气体多少皆作为产气论),即证实有大肠菌群存在。根据证实有大肠菌群存在的阳性管(瓶)数查表2-5“大肠菌群检数表” ,报告每升水样中的大肠菌群数。
4.2 水源水
4.2.1 于各装有5ml三倍浓缩乳糖蛋白胨培养液的5个试管中(内有倒管),分别加入10ml水样;于各装有10ml乳糖蛋白胨培养液的5个试管中(内有倒管),分别加入
48
1ml水样;再于各装有10ml乳糖蛋白胨培养液的5个试管中(内有倒管),分别加入1ml 1:10稀释的水样。共计15管,三个稀释度。将各管充分混匀,置于37℃恒温箱内培养24h。
4.2.2 平板分离和复发酵试验的检验步骤同“生活饮用水检验方法”。
4.2.3 根据证实总大肠菌群存在的阳性管数,查附表2-6“最可能数(MPN)表”,即求得每100ml水样中存在的总大肠菌群数。我国目前系以1L为报告单位,故MPN值再乘以10,即为1L水样中的总大肠菌群数。
对污染严重的地表水和废水,初发酵试验的接种水样应作1:10、1:100、1:1000或更高倍数的稀释,检验步骤同“水源水”检验方法。
如果接种水的水样量不是10ml、1ml和0.1ml,而是较低或较高的三个浓度的水样量,也可查表求得MPN指数,再经下面公式换算成每100ml的MPN值。
MPN值=MPN指数×10(ml)/接种量最大的一管(ml)
表2-5 大肠菌群检数表
接种水样总量300ml(100ml 2份,10ml 2份)
100mL水量的阳性瓶数
10mL水量的阳性管数
1L水样中大肠菌群数
0 1 2 3 4 5 6 7 8 9 10
3 3 7 11 14 18 22 27 31 36 40
1
1L水样中大肠菌群数
4 8 13 18 24 30 36 43 51 60 69
2
1L水样中大肠菌群数
11 18 27 38 52 70 92 120 161 230 230
49
表2-6 最可能数(MPN)表
(接种5份10ml水样、5份0.1ml水样时,不同阳性及阴性情况下100ml水样中细
菌数的最可能数和95%可信限值)
出现阳性份数 10ml 1ml 0.1ml 管 0 0 0 0 1 1 1 1 1 2 2 2 2 2 2 3 3 3 3 3 3 3 4 4 4 4 4 4
管 0 0 1 2 0 0 1 1 2 0 0 1 1 2 3 0 0 1 1 2 2 3 0 0 1 1 1 2
管 0 1 0 0 0 1 0 1 0 0 1 0 1 0 0 0 1 0 1 0 1 0 0 1 0 1 2 0
每100ml水样中 95%可信
细菌数的 最可能数 <2 2 2 4 2 4 4 6 6 5 7 7 9 9 12 8 11 11 14 14 17 17 13 17 17 21 26 22
<0.5 <0.5 <0.5
7 7 7
出现阳性份数 管 4 4 4 4 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5
管 2 3 3 4 0 0 0 1 1 1 2 2 2 3 3 3 3 4 4 4 4 4 5 5 5 5 5 5
管 1 0 1 0 0 1 2 0 1 2 0 1 2 0 1 2 3 0 1 2 3 4 0 1 2 3 4 5
每100ml水样中 95%可信限值
细菌数的 最可能数 26 27 33 34 23 34 43 33 46 63 49 70 94 79 110 140 180 130 170 220 280 350 240 350 540 920 1600 ≥2400
下限 9 9 11 12 7 11 15 11 16 21 17 23 28 25 31 37 44 35 43 57 90 120 68 120 180 300 640
上限 78 80 93 93 70 89 110 93 120 150 130 170 220 190 250 310 500 300 190 700 850 1000 750 1000 1400 3200 5800
下限 上限 10ml 1ml 0.1ml
<0.5 11 <0.5 11 <0.5 11 <0.5 15 <0.5 15 <0.5 13 1 1 2 2 3 1 2 2 4 4 5 5 3 5 5 7 9 7
17 17 21 21 28 19 25 25 34 34 46 46 31 46 46 63 78 67
50
第二篇:间接ELISA法测定大肠杆菌DH5α菌体蛋白含量的实验研究
间接ELISA法测定大肠杆菌DH5α菌体蛋白含量的实验研究 免疫学杂志 19xx年第4期第15卷 技术与方法
作者:邓瑞春 白云秀 张明伟 汪劲松 黄 英 毛 宁
单位:军事医学科学院瑞得四环生物技术研究所 北京 100850
关键词:酶联免疫吸附测定 粒细胞巨噬细胞集落刺激因子 大肠杆菌
摘 要 采用大肠杆菌DH5α菌体蛋白免疫家兔制备抗血清,建立了间接ELISA方法经初步测定,该方法的灵敏度0.5ng/ml,比聚丙烯酰胺凝胶电泳的考马斯亮蓝染色方法的灵敏度高3 000倍,比银染色方法的灵敏度高150倍。在20~620ng/ml范围内测定呈直线关系,直线相关系为0.895。经8次重复测定,显示很好的重复性。可用于测定rhGM-CSF等基因工程产品中DH5α菌体蛋白的残余量。
中图号 R371-34
DETERMINATION OF THE E.COLI DH5α PROTEIN REMAINS IN
GENIC ENGINEERING SEMI-FINISHED PRODUCT GM-CSF
Deng Ruichun, Bai Yunxiu, Zhang Mingwei, Wang Jinsong, Huang Ying, Mao Ning
(Read Four-Ring Institute of Biotechnology, Academy of Military Medical Sciences, Beijing 100850)
Abstract The antiserum were prepared against the total DH5α protein by immunizing rabbits, and then a method was established to determine the remnants E.coli DH5α protein in the gene engineering semi-finished pro-duct of rhGM-CSF. The sensitivity is about 0.5ng/ml, 3 000 times higher than that of Coomasie Briliant Blue stai-ning and 150 times than that of silver staining of PAGE. The linear range of the method is between 20-620ng/ml and the correlation coefficient(r) is 0.985, and repeativity is good.
Key words Enzyme-liked immunosorbentassay(ELISA),Recombine human granulocyte-macrophage colony-stimulating factor(rhGM-CSF), Escherichia coli(E.coli)
大肠杆菌DH5α是目原核细胞表达系统中,应用最普遍的基因工程菌之
。人重组粒细胞巨噬细胞集落刺激因子(rhGM-CSF)、人重组白细胞介素-2(rhIL-2)、人重组干扰素-α(rhIFN-α)等外源基因,都是在该宿主菌中获得高效转录和表达的。随着对基因工程产品在临床上的大量应用,对产品中宿主蛋白残余量的要求越来越严格。目前常用来鉴定残余蛋白的方法有:聚丙烯酰胺凝胶电泳(SDS-PAGE),毛细管电泳(CE),等电聚焦(IEF),HPLC(包括凝胶过滤,各种反相HPLC,离子色谱,疏水色谱等)。此外,还有一些化学法如观察末端是否均一等等。本文建立了间接ELISA方法,它简便、快速、灵敏、经济,是一种非常值得推广的方法。
1 材料和方法
1.1 材料
大肠杆菌DH5α菌体蛋白,由本室培养制备;HRP-羊抗兔IgG,购自本院微生物流行病学研究所;Western印迹试剂盒,购自Sigma公司;卡介苗,购自北京生物制品所。BDSL Immunoskan 340型酶联仪,英国;电泳仪,购自北京六一仪器厂。
1.2 方法
1.2.1 大肠杆菌DH5α培养及菌体蛋白的测定:于LB培养基中培养大肠杆菌DH5α,经离心收集菌体,生理盐水洗2次,超声破碎,离心15 000r/min 10min,收集上清菌体蛋白,紫外分光光度法测定蛋白光吸收值,通过公式:mg/ml蛋白=1.45×OD280-0.74×OD260计算含量,SDS-PAGE对DH5α菌体蛋白成分进行分析。
1.2.2 大肠杆菌DH5α菌体蛋白免疫:于免疫前1周,兔两侧腹股沟淋巴结注射卡介苗0.7mg,取4mg大肠杆菌DH5α菌体蛋白与1ml福氏完全佐剂混合,制成乳剂,于背部皮下多点免疫;2周后,注射不完全佐剂,免疫原剂量同前。随后,每隔2周加强1次,连续注射3次,最后1次自腹腔注射9mg抗原蛋白。7d后放血,收集血清,分装,于-20°C保存。
1.2.3 抗体效价测定:按文献[1]琼脂糖免疫双相扩散法。制备1%琼脂糖胶,铺板,打梅花孔。中心孔加1mg/ml菌体蛋白,周边孔加入倍比稀释的抗血清,放湿盒中,48h后观察结果。
ELISA方法按文献[1]的方法。抗原包被量为4μg/ml,HRP-羊抗兔IgG的使用浓度为1 000倍稀释,底物为邻苯二胺。
1.2.4 聚丙烯酰胺凝胶电泳:按文献[3]进行。分离胶浓度8%,浓缩胶浓度5%。电极缓冲液25mmol/L Tris-192mmol/L甘氨酸。 [3,4]
1.2.5 银染方法:将电泳胶用50%乙醇-12%醋酸固定20min,10%乙醇-5%醋酸洗3次,每次10min。取0.25% K2Cr2O7溶液浸泡7min,用去离子水洗2次,每次2min。将电泳胶浸泡于0.2% AgNO3溶液中,在20W日光灯下爆光20min,关灯放置20min,期间摇动若干次,至无色为止。无离子水洗3次,每次0.5min于摇动中加入0.28mol/L Na2CO3-0.05%甲醛,2~3次,视显色情况而定。1%醋酸定影10min,然后保存于去离子水中。
1.2.6 Western印迹实验:见参考文献[3]。电泳分离的蛋白带转移至硝酸纤维素膜上,封闭膜上非特异性结合位点,加入兔抗大肠杆菌DH5α菌体蛋白血清,清洗后加酶标二抗,温育后清洗,用3.3′-二氨基联苯胺(DAB)染色。 1.2.7 免疫电泳:见参考文献[1]。
1.2.8 测定大肠杆菌DH5α菌体蛋白的间接ELISA分析法:用0.05mol/L pH9.5碳酸盐缓冲液稀释的DH5α抗原溶液包被聚苯乙烯板,放4°C过液,次日用PBST洗涤3次,每次振荡3min。3% BSA-PBST封闭,37°C温育1h,同上洗涤。加入用1%BSA-PBST稀释的兔抗DH5 α抗血清,37°C温育1h,同上洗涤。加1%BSA-PBST配制的HRP-羊抗兔IgG,37°C温育1h,同上洗涤。加底物液,避光反应20min, 2mol/L H2SO4终止反应后,492nm测定吸光度。 2 结果与分析
2.1 抗血清效价测定 用DH5 α全菌蛋白作为抗原,免疫7只家兔,每只家兔免疫5次,所用抗原量分别为:4,4,4,10和9mg。用琼脂糖免疫双扩散法测定抗体效价。从表1可见,当免疫第3次(约定42d)时,抗体效价即可达1∶64倍,第4次时可达1∶128倍。但免疫到第5次时并未见效价继续升高。 表1 兔抗大肠杆菌DH5α菌体蛋白抗血清效价
Tab 1 The titer of the antisera against the total DH5α proteins 全屏显示表格
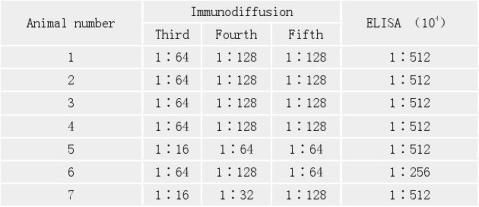
表中还列出了ELISA法测定结果,即:除第6号家兔抗体效价稍低
(1∶256×104)外,其余6只家兔抗体效价均达到1∶512×104。说明我们已经制备了高效价的抗血清。
2.2 抗体特异性测定 图1为琼脂糖免疫电泳结果。7只家兔抗血清与抗原之间都能产生沉淀线,但不同个体所产生的沉淀线深浅度并不一样,这说明不同个体对不同抗原的免疫反应强度不同。该结果提示:在将抗体作为免疫诊断试剂使用时,应使用混合血清的抗体,这对保证所建方法有好的重复性,具有十分重要的意义。
图 1琼脂糖免疫电泳
Fig 1Agrose immunoelectrophoresis
①~⑦ antisera of rabbits to E.coli DH5 α proteins respectively;⑧ The mixture of the seven rabbits antisera; ⑨The total DH5α proteins 图2为DH5α菌体蛋白与抗体间的免疫印迹反应。首先,本实验免疫的7只家兔的抗血清,与抗原蛋白之间都能产生免疫印迹条带,说明每种抗原都已刺激机体产生了相应的抗体。换句话说,我们制备的抗体,能与任何DH5α抗原反应。但与GM-CSF之间没有免疫印迹条带出现。说明这些抗体不与GM-CSF反应。可见,我们制备的抗体,不仅效价高,而且特异性好,它能特异地与GM-CSF等基因工程产品的宿主蛋白反应,但不能与这些基因工程产物反应。
2.3 方法的灵敏度、重复性和标准曲线 用间接ELISA方法测定该方法的灵敏度,结果见表2。从表2可见,当抗体稀释5×104倍时,可测抗原浓度为0.5ng/ml。显示该方法具有较好的灵敏度,实验共重复8次,说明该方法具有很好的重复性。
图 2DH5 α与抗体间的免疫印迹反应
Fig 2The western blot betwean DH5α and antisera
(1)~(7)antisera of rabbits to E.coli DH5 α proteins respectivily;
(8)The mixture of the seven rabbits antisera;(9)Nor-mal rabbits serum;
(10)、(12)GM-CSF;(11)Marker
表2 ELISA法测定DH5 α菌体蛋白的灵敏度、重复性(抗体稀释5×104) Tab 2 The sensitivity and respectivity of the ELISA method
(The antibody is diluted 5×104) 全屏显示表格
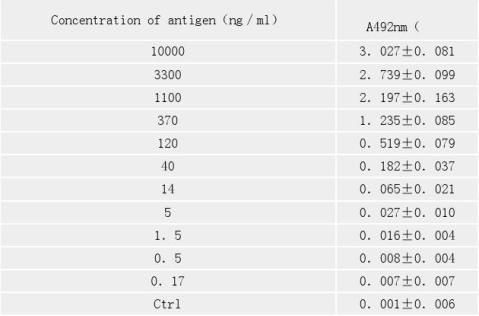
2.4 ELISA法测定DH5 α的标准曲线 从图3可见,在20ng/ml到620 ng/ml范围内呈直线关系,直线回归系定的结果比较接近
0.985,说明在此直线范围内,测
2.5 与PAGE方法比较 将DH5α蛋白经聚丙烯酰胺凝胶电泳后,进行考马斯亮兰染色和银染,/ml。两
者最小检测值为1 500ng/ml,后者最小检测值为75ng
方法检测灵敏度分别低于本实验建立的ELISA方法(0.5 ng/ml)
3 000倍和150倍。进步说明本实验建立的方法具有较好的灵敏度。适合于
基因工程产品中残余蛋白的检测。
图 3间接ELISA法动力学曲线
Fig 3The kinetic curve of indirect ELISA 3 讨论
肠杆菌DH5α在基因工程产品中的残余量,直接影响到产品的质量。快速准确地测定DH5α的残余量,对产品的质量控制具有重要意义,其检测方法尚在不断改进和完善。目前常用的SDS-PAGE法灵敏度较低,且操作繁琐,耗时较长。毛细管电泳和高效液相色谱法虽然灵敏度较高,但需昂贵仪器,非一般实验室所能接受。
本文建立的间接ELISA方法,通过对DH5α蛋白及rhGM-CSF样品进行初步测量显示:它的灵敏度很高,可测定0.5 ng/ml菌体蛋白量,比现在常用的聚丙烯酰胺的考马斯亮兰染色方法的灵敏度高3 000倍,比银染色方法灵敏度高150倍。标准曲线范围在20~620 ng/ml,直线回归系数为0.985。重复性、稳定性都较好,方法简便、快速。我们认为,该方法可以应用于基因工程产品中菌体蛋白残余量检测。
(致谢 本文曾得到丁广志教授和樊玉伟同志的热情帮助,特此致谢。) 第一作者:女,37岁,硕士,助理研究员
参考文献
1 李成文.现代免疫化学技术.上海:上海科学技术出版社,1990.8
2 张龙翔,吴国利.高级生物化学实验选编.北京:高等教育出版社,1989.9 3 J.萨母布鲁克,E.F.弗里奇,T.曼尼阿蒂斯著.分子克隆实验指南.第2版.金冬雁、黎孟枫、侯云德等译,北京:科学出版社,1992
4 张龙翔,张庭芳,李令媛.生化实验方法和技术.第2版.北京:高等教育出版社,1997
(1998-09-23收稿;1999-03-16修回
-
实验五 水中细菌总数的测定
实验五水中细菌总数的测定实验目的l学习水样的采取方法和水样细菌总数测定的方法2了解水源水的平板菌落计数的原则基本原理本实验应用平板…
-
水中细菌总数的测定
水中细菌总数的检测1实验目的1学习并掌握水的细菌学检测方法2了解水质状况与细菌数量在饮用水检测中的重要性2菌落总数standard…
-
微生物综合性实验__水中细菌总数的测定
微生物综合实验水中细菌总数的测定一实验目的1学习水样的采集和水样中细菌总数的测定方法2了解和掌握平板菌落计数的原则3复习巩固微生物…
-
微生物实验报告:水中细菌总数和大肠菌群的检测
实验六水中细菌总数和大肠菌群的检测摘要本实验以测定公园河流水的细菌总数和大肠菌群的数量来测定特定地点的水质情况初步介绍了一种通用的…
-
水中细菌总数及大肠菌群的同时测定实验方案 Microsoft Word 文档
福建医科大学人工湖水体中细菌总数及大肠菌群数的检测实验方案实验组员陈秋香陈志明林玲李淋管修标一实验目的1学习水样的采取方法和水样细…
-
老师整理的实验报告 水处理微生物学标准实验报告10 实验十 细菌菌落总数(CFU)的测定
南昌大学实验报告学生姓名:学号:专业班级:实验类型:验证□综合□设计□创新实验日期:实验成绩:实验十细菌菌落总数(CFU)的测定一…
-
微生物实验报告:水中细菌总数和大肠菌群的检测
实验六水中细菌总数和大肠菌群的检测摘要本实验以测定公园河流水的细菌总数和大肠菌群的数量来测定特定地点的水质情况初步介绍了一种通用的…
-
水中细菌总数的测定和大肠菌群的检测
水中细菌总数的测定和大肠菌群的检测1录入时间20xx925111729来源生物信息网一实验目的1了解和学习水中细菌总数和大肠菌群的…
-
实验八 水中菌落总数的测定
实验八水中菌落总数的测定及染色观察一实验目的掌握国标中关于水中细菌总数的测定基本原理和方法熟悉水体中细菌总数的检验方法检验原理检验…
-
实验五 水中细菌总数的测定
实验五水中细菌总数的测定实验目的l学习水样的采取方法和水样细菌总数测定的方法2了解水源水的平板菌落计数的原则基本原理本实验应用平板…
-
大肠杆菌实验报告
大肠杆菌紫外线诱变及抗药性菌株筛选1.前言抗生素能破坏细菌细胞壁的结构,使细菌的繁殖和生长受到抑制。但某些细菌对抗生素表现出抗性,…