实验六__盐酸萘乙二胺分光光度法测定空气中的氮氧化物
盐酸萘乙二胺分光光度法测定空气中的氮氧化物
一、样品采集
用一支内装5.00ml吸收液的多孔玻板吸收管,进气口接氧化管,并使管口略微向下倾斜,以免当湿空气将氧化剂(三氧化铬)弄湿时,污染后面的吸收液体。以0.4L/min流量,避光采样至吸收液呈微红色为止,记下采样时间,密封好采样管,带回实验室,当日测定。采样时,若吸收液不变色,则采气量应不少于12L。
1,采集地点
实验C楼3楼实验室的窗口,当时天气阴,目测云量较多,有零星小雨。
当日气温20.1℃,相对湿度100%,气压1008hPa,风向偏东风1.4级。(由闵行区气象局20##年5月24日9时57分发布。)
2,性状描述
样品在玻板吸收管中,有较多的气泡,液体颜色略显微弱的粉红色。
二、样品预处理与分析测试
1、主要实验步骤
(1)绘制标准曲线:
取7支10ml具赛比色管,按下表配置标准比色列
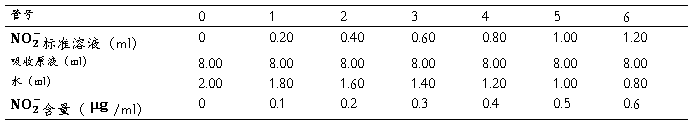
各管摇匀后,避开直射阳光,放置15分钟,在波长540nm处,用1cm比色皿,以水为参比,测定吸光度。
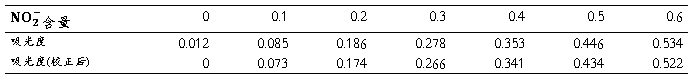
测定的吸光度以及扣除空白后的校正吸光度如下表:
根据上表绘制的标准曲线如下图:
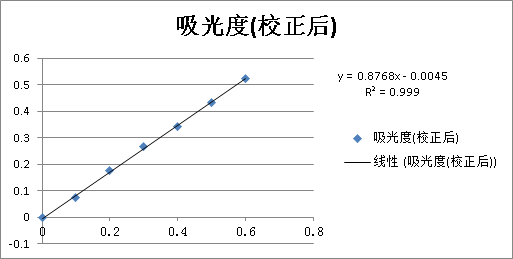
其回归方程为:

其中:y—标准溶液吸光度与试剂空白液吸光度之差
x—亚硝酸根的含量( /ml)
/ml)
(2)样品测定
采样后,放置15分钟,将样品溶液移入1cm比色皿中,用绘制标准曲线的方法测定试剂空白液和样品溶液的吸光度。若样品溶液的吸光度超过标准曲线的测定上限,可以吸收液稀释后再测定吸光度。计算结果时应乘以稀释倍数。
2、计算结果
氮氧化物( ,mg/
,mg/ )=
)=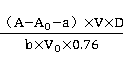
 =
=
 =采样流量
=采样流量

根据以上公式计算结果为:0.11mg/
三、结果分析
氮氧化物是形成光化学烟雾和酸雨的重要原因,同时也对人体的肺部产生伤害,引发呼吸道疾病。本次实验结果表明华师大闵行校区空气中的氮氧化物含量较低,校园内大气环境较好。
(1)数据分析
根据中华人民共和国国家环境保护标准HJ479-2009,盐酸纳乙二胺分光光度计方法适用于测定环境中的氮氧化物,检出限为0.36 /10ml吸收液。当吸收液总体积为10ml,采样体积为24L时,空气中的氮氧化物的检出限为0.015mg/
/10ml吸收液。当吸收液总体积为10ml,采样体积为24L时,空气中的氮氧化物的检出限为0.015mg/ 。当吸收液总体积为50ml,采样体积为288L时,空气中氮氧化物的检出限为0.006mg/
。当吸收液总体积为50ml,采样体积为288L时,空气中氮氧化物的检出限为0.006mg/ 。本次试验所用的吸收液为5ml,采样体积为6L,空气中的氮氧化物检出限应在0.03mg/
。本次试验所用的吸收液为5ml,采样体积为6L,空气中的氮氧化物检出限应在0.03mg/ 左右。本次实验结果满足这一检出限。
左右。本次实验结果满足这一检出限。
该标准规定的 标准气体的测定质量浓度范围在0.056~0.480mg/
标准气体的测定质量浓度范围在0.056~0.480mg/ ,相对误差在
,相对误差在 以内。本次实验的结果为0.11mg/
以内。本次实验的结果为0.11mg/ ,属于偏低的范畴。
,属于偏低的范畴。
大气中的氮氧化物主要来源于燃料的燃烧,如:工业原料、汽车燃料以及焚烧麦秆等,另外还有农业土壤以及动物排泄物中含氮化合物的转化。在人口稠密、交通发达的城市中,主要影响因素是汽车的尾气。在本次试验所采样的地区,因靠近工业区,还应考虑化工企业对空气中氮氧化物的影响。
实验楼区域车辆通行并不频繁,相对比较幽静,因此汽车尾气对空气中的氮氧化物含量影响并不显著。当日天气阴沉,有零星小雨,考虑到二氧化氮具有可溶性,且有文献显示空气中二氧化氮的含量,晴天是雨天的1.2至2.1倍(天候对通勤者氮氧化物暴露的影响,陈志郎等,元培科技大学环境工程卫生系),因此天气可能也是影响大气中氮氧化物含量的一个因素。
(2)误差分析
本次试验用5ml吸收液绘制标准曲线,标准曲线的斜率应控制在0.180~0.195吸光度*ml/ ,截距控制在
,截距控制在 之间。本次实验所绘制的标准曲线斜率远远大于该标准斜率。分析可能造成误差的原因,有以下几种:
之间。本次实验所绘制的标准曲线斜率远远大于该标准斜率。分析可能造成误差的原因,有以下几种:
(1)  标准溶液系列中的各管应在摇匀后置于暗处,放置20min,当室温低于20℃时,应放置40min以上。在本次实验中,我们配好
标准溶液系列中的各管应在摇匀后置于暗处,放置20min,当室温低于20℃时,应放置40min以上。在本次实验中,我们配好 标准溶液后,尚未置于暗处,就立即进行了吸光度的检验。这样会造成吸光度增大,因此整个标准曲线中,各点数值均较大,据此计算出的斜率也随之变大。
标准溶液后,尚未置于暗处,就立即进行了吸光度的检验。这样会造成吸光度增大,因此整个标准曲线中,各点数值均较大,据此计算出的斜率也随之变大。
(2) 实验所采的样品也应该放置于暗处20min,当室温低于20℃时,应放置40min以上。我们在拿到实验样品后就立即移入比色管中,随后进行了比色,前后不超过10min。因此对样品的实际吸光度有些影响。实验室空白样品的吸光度也明显偏大,该标准规定:吸收液的吸光度应小于等于0.005,而本次实验所得的吸收液吸光度为0.012。
(3) 在各组分取吸收液并配置 标准溶液时,使得吸收液长时间暴露在光线和空气中,配置好溶液后,也未及时塞紧比色管的塞子。造成吸收液显色或者吸收空气中的氮氧化物,使测试结果变大。
标准溶液时,使得吸收液长时间暴露在光线和空气中,配置好溶液后,也未及时塞紧比色管的塞子。造成吸收液显色或者吸收空气中的氮氧化物,使测试结果变大。
第二篇:3-2空气中氮氧化物的测定(盐酸萘乙二胺分光光度法)(1)
实验题目: 空气中氮氧化物的测定
姓 名: 学 号:
班 级: 组 别:
指导教师:
1.实验概述
1.1实验意义和目的
氮的氧化物主要有:NO、NO2、N2O3、N2O4、N2O5、N2O等,大气中的氮氧化物主要以NO、NO2形式存在,简写NOX。NO是无色、无臭气体,微溶于水,在大气中易被氧化成NO2;NO2是红棕色有特殊刺激性臭味的气体,易溶于水。
NOX的主要来源于硝酸、化肥、燃料、炸药等工厂产生的废弃、燃料的高温完全燃烧、交通运输等。NOX不仅对人体健康产生危害(呼吸道疾病),还是形成酸雨的主要物质之一。
主要测定方法有盐酸萘乙二胺分光光度法(GB8968-88)、中和滴定法或二磺酸酚分光光度法(GB/T13906-92)、Saltzman法(GB/T15436-1995)、化学发光法等。
通过本次实验,我们熟悉了空气中二氧化氮的来源与危害,也能够掌握空气采样器的使用方法及用溶液 吸收法采集空气样品,学会掌握了用分光光度法测定二氧化氮的原理与操作,学会了分光光度分析的数据处理方法,还能够初步了解化学发光法测定二氧化氮的原理。
1.2实验原理
空气中的NO2被吸收液吸收后,生成HNO3和HNO2,在冰乙酸存在下,HNO2与对氨基苯磺酸发生重氮化反应,然后再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料,其颜色深浅与气样中NO2的浓度成正比,因此可进行分光光度测定,在540nm测定吸光度。
该法适于测定空气中的氮氧化物,测定范围为0.01~20mg/m 。
。
方法特点:该法采样和显色同时进行,操作简便、灵敏度高。NO、NO2课分别测定,也可以测NOX总量。测NO2时直接用吸收液吸收和显色。测NOX时,则应将气体先通过CrO3-砂子氧化管。将能够中的NO氧化成NO2,然后再通入吸收液吸收和显色。
1.3 实验注意事项
(1)吸收液应避光。防止光照使吸收液显色而使空白值增高。
(2)如果测定总氮氧化物,则在测定过程中,应注意观察氧化管是否板结,或者变成绿色。若板结会使采样系统阻力增大,影响流量;若变绿,表示氧化管已经失效。
(3)吸收后的溶液若显黄棕色,表明吸收液已受到三氧化铬的污染,该样品应报废,重新配制吸收液后重做。
(4)采样过程中放置太阳光照射。在阳光照射下采集的样品颜色偏黄,非玫瑰红色。
2.实验内容
2.1 实验仪器
1、空气采样器,流量范围0~1L/min,2个(做平行采集)。
2、多孔玻筛板吸收管10ml,3个(两个用于平行采集,一个用作空白采样)。
3、双球吸收管,2个。
4、比色皿,2个。
5、具塞比色管,6个。
6、分光光度计。
2.2 实验药品和试剂
冰乙酸;盐酸萘乙二胺;对氨基苯磺酸;亚硝酸钠;CrO3。
1、显色液
(1) 盐酸萘乙二胺贮备液,ρ=1.00g/L。
称取0.50g药品于500ml棕色容量瓶,用水溶液稀释至刻度,放在冰箱中可稳存三个月。
(2) 冰乙酸
(3) 对氨基苯磺酸
称取5.0g对氨基苯磺酸于200ml烧杯中,加蒸馏水移至1000ml棕色容
量瓶中,加入50ml冰乙酸,再加入50ml盐酸萘乙二胺贮备液,用蒸馏水稀释至刻度,于冰箱中可稳存一个月。若溶液呈淡红色,则弃之重配。
2、吸收液
将显色液和水按4:1体积比例混合,即为吸收液,吸收液的吸光度应≤
0.005。.
3、亚硝酸盐贮备液,ρ=250μg/ml。
称取0.1875g亚硝酸钠于烧杯中溶解,然后移至500ml棕色容量瓶,加入蒸馏水稀释至刻度。在暗处课稳存三个月。
4、亚硝酸盐使用液
准确吸取亚硝酸盐贮备液1.00ml于100ml容量瓶中,用水稀释至标线,现用现配。
5、1+2盐酸
将蒸馏水和浓HCl按1:2体积比混合,泡砂使用。
6、CrO3-砂子
(1)将河沙洗净,晒干,筛去20-40目的部分;
(2)用1+2盐酸浸泡一夜,水洗至中性后烘干;
(3)将CrO3与砂子按1:20的质量比混合,加入少量水调匀;
(4)将CrO3-砂子放于烘箱于105℃烘干,烘干过程应搅拌数次,最终CrO3-砂子是松散的。
7、CrO3-砂子氧化管
将CrO3-砂子装入双球玻璃管中,两端用脱脂棉塞好,并用塑料制的小帽子将管两端盖紧,备用。
2.3实验过程(实验步骤、记录、数据、分析 )
2.3.1测定步骤
1)标准曲线的绘制
取6支10ml具塞比色管,按照表3.2参数和方法配制NO2 标准溶液系列(亚硝酸标准适用液浓度为2.5ug/ml)。各管摇匀后,避开直射阳光,放置20分钟,在波长540nm处,用1cm比色皿,以蒸馏水为参比,测定吸光度A。
标准溶液系列(亚硝酸标准适用液浓度为2.5ug/ml)。各管摇匀后,避开直射阳光,放置20分钟,在波长540nm处,用1cm比色皿,以蒸馏水为参比,测定吸光度A。
表3.2 二氧化氮标准系列的配制


绘制标准曲线,求出一元线性回归方程:
Y(吸光度)=0.8212X(NO2-)+0.005
2)空气样品的采集
(1)现场空白样品的采集
采集二氧化氮样品时,应准备一个现场空白吸收管,和其他采样吸收管同时带到现场。该管不采样,采样结束后和其他采样吸收管一起带回实验室,进行测定。
(2)二氧化氮现场平行样品的采样
用两台相同型号的采样器,以同样的采样条件(包括时间、地点、吸收液、流量、朝向等)采集两个气体平行样。在采样的同时记录现场温度和大气压力。
采样时,移取10.0mL吸收液置于气泡吸收管中,用尽量短的硅橡胶将其与采样器相连。以0.4L/min流量采气4~24L。
移取10.0mL吸收液置于气泡吸收管中,用尽量短的硅橡胶管将其与采样器相连。以0.2~0.4L/min流量,避光采样至吸收液呈微红色为止。记录采样时间,密封好采样管,带回实验室测定。
表3.3 空气中二氧化氮的采样记录

在采样的同时记录现场温度和大气压力
3)样品的测定
采样后于暗处放置20min(室温20℃以下放置40min以上)后,用水将吸收管中的体积补充至刻线,混匀,按照绘制标准曲线的方法和条件测量试剂空白溶液和样品溶液及现场空白样的测定的吸光度。
当现场空白值高于或低于空白值时,应以现场空白值为准,对该采样点的实测数据进行校正。
表3.4 二氧化氮样品的测定

6.数据处理和数据分析
氮氧化物(NO ,mg/m ³)=(A-Ao-a) ·V/(b·f·Vo)
,mg/m ³)=(A-Ao-a) ·V/(b·f·Vo)
A、Ao:分别为样品溶液和试剂空白溶液的吸光度
a、 b:分别为标准曲线的斜率和截距。
V:移取吸收液的体积(mL)
Vo:换算为标准状态下的采样体积
f:Saltman实验系数,0.88
指导教师评语及成绩:
成绩: 指导教师签名
批阅日期
-
实验二 大气中氮氧化物的测定
实验二大气中氮氧化物的测定盐酸萘乙二胺比色法一目的要求1了解大气中监测采样器的结构和使用操作2熟悉用气体吸收比色法测定大气中气态污…
-
大气中氮氧化物的日变化曲线实验报告
环境化学实验报告实验项目空气中氮氧化物的日变化曲线实验考核标准及得分1一实验目的与要求1了解氮氧化物的具体种类及其来源2掌握氮氧化…
-
大气中氮氧化物的测定
大气中氮氧化物的测定一些环评报告中需要的检测方案几乎所有的大气污染物都需要检测氮氧化物了由于十二五计划将氮氧化物纳入总量控制指标这…
-
环境监测实验三 空气中氮氧化物(NOx)的测定
实验五空气中氮氧化物NOx的测定一实验目的及要求掌握盐酸萘乙二胺分光光度法测定大气中NOX的原理掌握大气NOx采样器的使用方法及注…
-
空气中二氧化硫的测定实验报告
实验十三空气中二氧化硫含量的测定甲醛溶液吸收盐酸副玫瑰苯胺分光光度法一概述二氧化硫SO2又名亚硫酸酐分子量为6406为无色有很强刺…
-
空气中二氧化硫的测定实验报告
实验十三空气中二氧化硫含量的测定甲醛溶液吸收盐酸副玫瑰苯胺分光光度法一概述二氧化硫SO2又名亚硫酸酐分子量为6406为无色有很强刺…
-
固定污染源排气中的氮氧化物环境监测实验报告
环境监测实验报告监测项目固定污染源排气中的氮氧化物监测人员复核人审核人报告日期20xx年8月日一监测项目固定污染源排气中的氮氧化物…
-
大气中氮氧化物的日变化曲线实验报告
环境化学实验报告实验项目空气中氮氧化物的日变化曲线实验考核标准及得分1一实验目的与要求1了解氮氧化物的具体种类及其来源2掌握氮氧化…
-
实验二 大气中氮氧化物的测定
实验二大气中氮氧化物的测定盐酸萘乙二胺比色法一目的要求1了解大气中监测采样器的结构和使用操作2熟悉用气体吸收比色法测定大气中气态污…
-
大气中氮氧化物的测定
大气中氮氧化物的测定一些环评报告中需要的检测方案几乎所有的大气污染物都需要检测氮氧化物了由于十二五计划将氮氧化物纳入总量控制指标这…