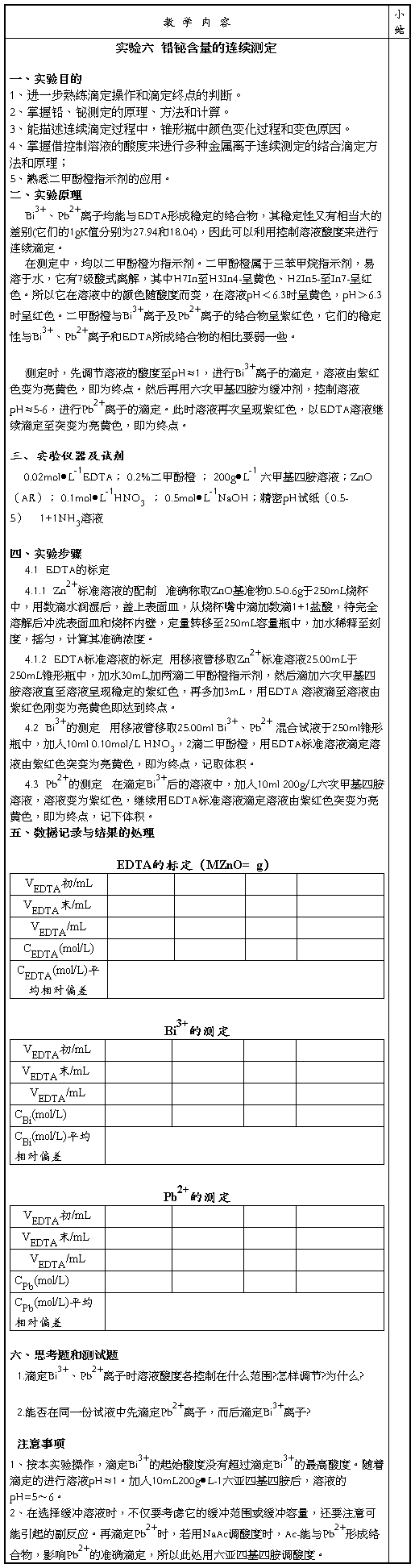
铅、铋混合液中铅,铋含量的连续测定
铅、铋混合液中铅,铋含量的连续测定
作者:
摘要: 在EDTA标准溶液的配制和标定实验中,学习EDTA标准溶液的配制和标定方法;掌握配
位滴定的原理,了解配位的特点称取一定质量的乙二胺四乙酸二钠固体配成溶液,用ZnO基准
物标定,并用二甲酚橙作为指示剂来标定EDTA的浓度。Bi3+、Pb2+离子均能与EDTA形成稳定
的络合物,其稳定性又有相当大的差别(它们的lgK稳值分别为27.94和18.04,△lgK>6),因
此可以利用控制溶液酸度来进行连续滴定。
测定时,先调节溶液的酸度至pH约等于1,进行Bi3+离子的滴定,溶液由紫红色突变为亮
黄色几位滴定终点。然后再用六亚甲基四胺为缓冲剂,控制溶液pH约等于5至6。此时溶液再
次呈现紫红色,再以EDTA溶液继续滴定Pb2+,当溶液由紫红色突变为亮黄色,即为滴定终点。
关键词: 二甲酚橙 ;络合滴定 ;连续滴定;铅铋混合溶液。 1 前言
EDTA是一种很好的氨羧络合剂,能和许多种金属离子生成很稳定的络合物,广泛用来滴定
金属离子。EDTA难溶于水,实验用的是它的二钠盐。标定EDTA溶液常用的基准物有金属Zn、
ZnO、CaCO3等,为求标定与滴定条件一致,可减少系统误差。掌握通过控制溶液酸度进行多种
金属离子连续滴定的络合滴定的原理和方法 ,熟悉二甲酚橙指示剂的应用,并且这个实验的成
败关键在于调节溶液的pH值,通常在硝酸铋溶解时,加入大量的硝酸,而滴定铋离子时溶液的
pH约为1.所以要用氢氧化钠溶液多次试调。为了使结果更精确,本实验平行操作5次。相对标
准偏差(RSD)??0.4%
2、试剂与仪器
2.1试剂:EDTA标准溶液(0.020mol·L-1),二甲酚橙(5 g·L-1水溶液),HNO3(0.10mol·L-1),
六次甲基四胺溶液(200g·L-1),Bi3+、Pb2+混合液,乙二胺四乙酸,HCl溶液(1∶1),NaOH溶
液(40g·L-1)。
仪器:酸式滴定管(50mL),锥形瓶(250mL),移液管(25mL),量筒(10mL),试剂瓶,烧杯,
分析天平。
2.2、实验步骤
2.2.1以ZnO为基准物标定 EDTA溶液
(1)锌标准溶液的配制:准确称取在800至1000摄氏度灼烧过(需20分钟以上)的基准物
0.5至0.6g于100mL烧杯中,用少量水润湿,然后逐滴加入1+1HCL,边加边搅至完全溶解为止。
然后将溶液定量转移入250mL容量瓶中,稀释至刻度并摇匀。
(2)标定:移取25mL锌标准溶液与250mL锥形瓶中,加约30mL水,2至3滴二甲基酚橙指
示剂,先加1+1氨水至溶液由黄色刚变橙色(不能多加),然后滴加200g/L六亚甲基四胺至溶
液呈稳定的紫红色后再多加3mL,用EDTA溶液滴定至溶液由红紫色变为亮黄色,即为终点。
2.2.2 Bi3+离子的滴定:移取25mL试液3份,分别置于250mL锥形瓶中。取一份作初步试验,先以pH为0.5至5范围的精密pH试纸试验试液的酸度。一般来说,不带沉淀的含Bi3+离子的试液其pH应在1以下,为此,以0.5mol/LNaOH溶液(装在滴定管中)调节之,边滴加边搅拌,并时时以精密pH试纸试之,至溶液pH达到1为止。记下所加的NaOH 溶液的体积。接着加入10mL0.1mol/L HNO3溶液及2至3滴0.2%二甲基酚橙指示剂,用0.02mol/L EDTA标准溶液滴定至溶液由紫红色变为棕红色,再加1滴,突变为亮黄色,即为终点,记下粗略读数。然后开始正式滴定。取另一份25mL试液,加入初步试验中调节溶液酸度时所需的相同体积的0.5mol/L NaOH溶液,接着再加10mL0.1mol/L HNO3溶液及2滴0.2%二甲基酚橙指示剂,用EDTA标准溶液滴定之,终点变化同上。在离终点1至2mL前可以滴得快一些,近终点时则反映慢一些,每加一滴,摇动并观察是否变色。
2.2.3 Pb2+离子的滴定:在滴定Bi3+离子后的溶液中,滴加200g/L的六亚甲基四胺,至溶液呈紫红色(或橙红色),再过量5mL,以0.02mol/L EDTA滴定至溶液由紫红经橙色突变至亮黄色为终点。 3、数据处理 1.EDTA的标定
EDTA质量为2.7225g,ZnO质量为0.5234g
d=0.00006 dr
=d*100%=0.3% S=0.00007 Sr=s*100%=0.3%
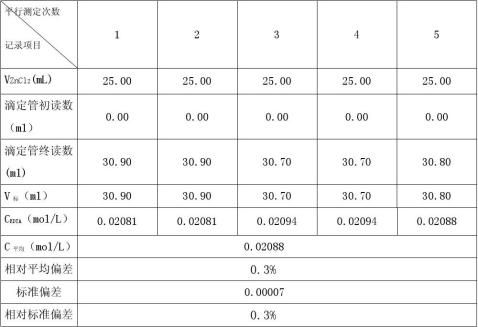
xx
μ=x?t
sn
=0.02088?0.00008(95%)2.Bi3+、Pb2+离子的连续测定
(1)Bi3+离子的测定
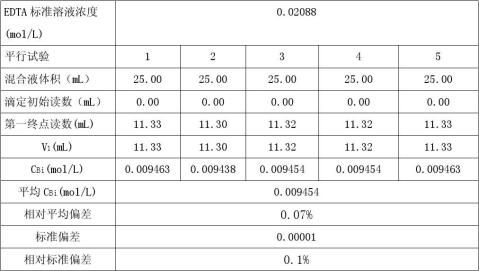
d=0.000007 dr
=d*100%=0.07% S=0.00001 Sr=s*100%=0.1% xx
μ=x?t
s
n
=0.009454?0.000012
(2)Pb2+离子的测定
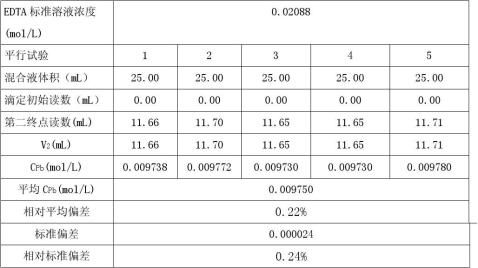
d=0.000021dr
=d*100%=0.22% S=0.000028 Sr=s*100%=0.29% xx
μ=x?t
sn=0.009750?0.000030
4、结果分析与讨论
1、指示剂的选择及用量
测定Bi3+、Pb2+均以二甲酚橙为指示剂。二甲酚橙属于三苯甲烷类指示剂,易溶于水,它有7级酸式解离,其中H7In至H3In4-呈黄色、H2In5-至呈红色In7-。所以它在溶液中的颜色随酸度而改变,在溶液pH<6.3时呈黄色,pH>6.3时呈红色。二甲酚橙与Bi3+离子及Pb2+离子的配合物呈紫红色,它们的稳定性与Bi3+、Pb2+离子和EDTA所成配合物的相比要弱一些。2、注意事项
测定Bi3+离子时若酸度过低,Bi3+将水解,产生白色浑浊,会使终点过早出现,而且产生回红现象,此时放置片刻,继续滴定至透明的稳定亮黄色,即为终点。滴定速度要慢,并且充分摇匀锥形瓶。
5、参考文献
1《分析化学实验》 第三版 四川大学化工学院、浙江大学化学系编
2《分析化学》 第五册 武汉大学 主编
第二篇:实验六 铅铋含量的连续测定
一、授课计划
二、课时教学内容
-
07实验七 铅、铋混合液中铅、铋含量的连续测定定-教案
实验七铅铋混合液中铅铋含量的连续测定教案课程名称分析化学实验B教学内容以二甲酚橙为指示剂连续测定铅铋混合液中铅铋含量实验类型验证教…
-
铅、铋混合液中铅,铋含量的连续测定
铅铋混合液中铅铋含量的连续测定作者摘要在EDTA标准溶液的配制和标定实验中学习EDTA标准溶液的配制和标定方法掌握配位滴定的原理了…
- 铅铋混合液实验报告
-
04实验4 铅、铋混合液中铅、铋含量的连续测定
实验四铅铋混合液中铅铋含量的连续测定实验日期实验目的进一步熟练滴定操作和滴定终点的判断掌握铅铋测定的原理方法和计算一实验原理Bi3…
-
实验四 铅铋混合液中铅、铋含量的连续测定
实验四铅铋混合液中铅铋含量的连续测定一实验原理利用控制酸度的方法连续测定lgKBiYlgKPbY2794180499gt5先用硝酸…
-
钻井液中固相含量的测定实验报告
中国石油大学油田化学实验报告实验日期成绩班级学号姓名教师同组者实验四钻井液中固相含量的测定一实验目的1掌握固相含量测定仪的操作方法…
-
溶液法测定极性分子的偶极矩实验报告
实验日期08年3月27日结构化学实验报告溶液法测定极性分子的偶极矩一实验目的1用溶液法测定正丁醇的偶极矩2了解偶极矩与分子电性质的…
-
最大泡压法测定溶液的表面张力实验报告
物理化学实验报告20xx年02月21日总评姓名学校陕西师范大学年级20xx级专业材料化学室温100大气压100kpa一实验名称最大…
-
水溶液电化学稳定窗口的测定实验报告
一实验目的1理解电位窗口的意义2掌握阴极极化曲线和阳极极化曲线的使用方法3测量玻碳电极在酸性中性和碱性溶液中的阳极和阴极极化曲线二…
-
EDTA标准溶液的配制和标定及铅、铋混合液中铅、铋含量的连续测定
EDTA标准溶液的配制和标定及铅铋混合液中铅铋含量的连续测定摘要在EDTA标准溶液的配制和标定实验中学习EDTA标准溶液的配制和标…