离子大量共存规律总结
离子大量共存规律总结
1. 离子共存问题是离子反应条件
所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2、熟记常考离子的性质
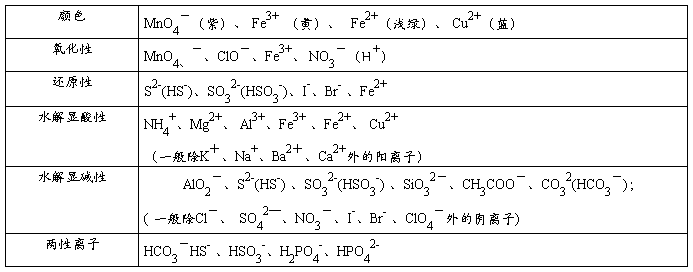
注:“两性离子”指既能与酸反应又能与碱反应的离子,一般多元弱酸的酸式酸根离子
3、离子间通常发生四种类型的反应,能互反应的离子不能大量共存。
(1)复分解反应
①、有沉淀生成。如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-等大量共存主要是由于Ba2++CO32-=CaCO3↓;Cu2+、Fe3+等不能与OH-大量共存也是因为Cu2++2OH-=Cu(OH)2↓, Fe3++3OH-=Fe(OH)3↓等。
②有气体产生。如CO32-、S2-、HS-、HSO3-、等易挥发的弱酸的酸根与H+不能大量共存,主要是由于CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑。
③有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-( 一般除Cl-、 SO42—、 NO3-、I-、Br- 、ClO4-外的阴离子)等与H+不能大量共存,主要是由于OH-+H+=H2O、CH3COO-+H+=CH3COOH;一些酸式弱酸根不能与OH-大量共存是因为HCO3-+OH-=CO32-+H2O、HPO42-+OH-=PO43-+H2O、NH4++OH-=NH3·H2O等。
(2)、发生氧化还原反应:具有较强还原性的离子不能与具有较强氧化性的离子大量共存
常见的氧化性离子:MnO4、-、ClO-、Fe3+、NO3-(H+)
常见的还原性离子:S2-(HS-)、SO32-(HSO3-)、I-、Br-、 Fe2+
注:Fe3+与Fe2+、 Br-能大量共存
(3)发生双水解反应:能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存。
常见的双水解:①Al3+、Fe3+和CO32(HCO3-)、S2-(HS-)、AlO2-、ClO-等
②NH4+和SiO32-、AlO2-
(4)络合反应:如Fe3+和SCN-、C6H5O-,由于Fe3++SCN- [Fe(SCN)]2+等络合反应而不能大量共存。
[Fe(SCN)]2+等络合反应而不能大量共存。
4、审题时应注意题中给出的附加条件和隐含条件。
(1)一色:溶液的颜色。
溶液无色时,则溶液中肯定没有有色离子存在。有色离子MnO4-,Fe3+,Fe2+,Cu2
(2)二性:溶液的酸性、碱性。

(3)三特殊:注意三种特殊情况
①注意溶液的酸性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4- 与Cl-在强酸性条件也不能共存; S2O32-在酸性条件下发生氧化还原反应,不能共存:S2O32-+2H+=S↓+SO2↑+H2O
②HCO3-与AlO2-发生双水解,不能大量共存。
③NH4+和CO32、HCO3-、CH3COO-等,虽然能发生双水解,但总的水解程度较小,因此能大量共存。
(4)注意题目要求“一定能大量共存”还是“可能大量共存”;“能大量共存”还是“不能大量共存”。
离子共存习题
1.某无色透明的溶液,在pH=0和pH=14的条件下都能大量共存的是( )
A.Fe2+、K+、SO42-、NO3- B.Mg2+ 、NH4+、SO42-、Cl-
C.Na+、K+、SO42-、NO3- D.Ba2+ 、Na+ 、MnO4- 、SO42-
2.(双选)下列澄清透明的溶液中,可能大量共存的离子组是
A.[Ag(NH3)2]+、K+、OH-、NO3- B.Fe3+、NH4+、Cl-、I-
C.H+、Al3+、SO42-、F- D.NH4+、Na+、Cu2+、Cl-
3.下列离子在溶液中因发生氧化还原反应而不能大量共存的是 ( )
A.H3O+、NO3-、Fe2+、Na+ B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、OH-
4.某溶液中加入铝粉有氢气产生,该溶液中一定可以大量共存的离子组是( )
A.Na+、NO3-、Cl-、SO42- B.Na+、K+、Ba2+、HCO3-
C.Fe3+、H+、SO42-、Cl- D.Na+、K+、Cl-、SO42-
5.常温下,由水电离生成的c(H+)=10-12 mol·L-1的某溶液中,一定不能大量共存的离子组是( )
A.Na+、Fe3+、NO3-、SO42- B.K+、AlO2-、CO32-、Cl-
C.Na+、K+、Cl-、HSO3- D.Na+、CH3COO-、C6H5O-、OH-
6.在室温下,某无色透明溶液中由水电离出来的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.Cu2+、Cl-、SO42- 、K+ D.SiO32-、SO32-、Na+、Cl-
7.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是
A.NH4+、Cu2+、Cl-、NO3- B.K+、Na+、SO32-、S2-
C.K+、Na+、AlO2-、SO42- D.Ba2+、Fe2+、NO3-、Br-
8(双选).下列各组离子在碱性条件下可以大量共存,而在强酸性条件下不能大量其存的是
A.Ca2+、Fe3+、NO3-、Cl- B.K+、Mg2+、HCO3-、SO42-
C.Na+、K+、S2-、SO32- D.Ba2+、Na+、I一、NO3-
9.下列各组离子一定能大量共存的是( )
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、AlO2—、CO32—
C.在c(H+)=10—13 mol/L的溶液中:NH4+、Al3+、SO42—、NO3—
D.在pH=1的溶液中:K+、Fe2+、Cl—、NO3—
10.下列各组无色溶液的离子组在pH=l时能大量共存的是
A.NH4+、C1-、Mg2+、SO42- B.A13+、Cu2+、SO42-、C1-
C.Ba2+、K+、NO3-、OH- D.Ca2+、Na+、C1-、A1O2-
11.下列各种情况下,溶液中可能大量存在的离子组是
A.使pH试纸呈红色的溶液中:I-、Cl-、NO3-、Na+
B.澄清透明的无色溶液中:K+、Mg2+、NO3-、MnO4-
C.在c(H+)/c(OH-)=1×1013的溶液中:NH4+、Ca2+、C1-、K+
D.含有较多的Al3+的溶液中:K+、Ca2+、ClO-、Cl-
12.在给定的四种溶液中,各离子能大量共存的是
A.滴加石蕊试液显红色的溶液: Fe3+、NH4+、Cl-、I-
B.能使pH试纸变为蓝色的溶液: Na+、CO32-、NO3-、SO32-
C.含有大量H+的无色溶液: Na+、Fe3+、NO3-、MnO4-
D.所含溶质为NaNO3的溶液: K+、HSO4-、C1-、S2-
13.常温下,下列各组离子在指定环境下能大量共存的是
A.pH=l的溶液中:Na+、K+、SO32-、MnO4-
B.pH=7的溶液中:Na+、A13+、Cl-、SO42-
C.pH>12的溶液中:Na+、K+、SO42-、AlO2-
D.pH=0的溶液中: Na+、K+、NO3-、ClO-
14.(双选)某无色溶液与NH4HCO3作用能产生气体(可加热),此溶液中可能大量共存的离子组是
A. Mg2+、H+、Zn2+、SO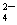 B.Na+、Ba2+、OH
B.Na+、Ba2+、OH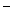 、SO
、SO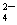
C.MnO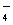 、K+、H+、SO
、K+、H+、SO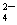 D.K+、NO
D.K+、NO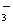 、OH-、Na+
、OH-、Na+
15.某溶液能使红色的石蕊试纸先变蓝色后褪色,则该溶液中可能大量共存的离子组是
A.K+、I—、AlO2—、MnO4— B.Na+、S2—、NO3—、SO42—
C.Al3+、NH4+、NO3—、F— D.K+、Cl—、ClO—、CO32—
16.在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C. c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
17.(双选)下列各组离子能大量共存,当溶液中c(H+)=10-1mol/L时,有气体产生;而当溶液中
c(H+)=10-13mol/L时,又能生成沉淀。该组离子可能是
A.Na+、Cu2+、NO3-、CO32- B.Ba2+、K+、Cl-、HCO3—
C.Fe2+、Na+、SO42-、NO3- D.Mg2+ 、NH4+、SO42-、Cl—
18.在pH=1的溶液中,大量存在着的阳离子是NH4+、Mg2+、Al3+、Fe2+,则溶液中还可能大量存在的阴离子是
A.Cl— B.ClO— C.HCO3— D.NO3—
19.已知pH=1的某溶液中存在较多的Ba2+、NO3-,则该溶液中还可能大量存在的离子组是
A.Fe3+、F-、Cl- B.Mg2+、SO42-、Br-
C.Mg2+、Cl-、Fe2+ D.Na+、NH4+、Cu2+
20.向某溶液里加入过量的氨水或过量的氢氧化钠溶液,均有沉淀产生;若加入铁粉或铜粉,溶液的质量都增加,则该溶液里一定含有下列离子中的
A.Al3+ B.Fe2+ C.Fe3+ D.Cu2+
21.(双选)下列各组离子能大量共存于同一溶液中,且加入少量NaOH溶液或适量稀H2SO4时,都能产生沉淀的是
A.Ba2+、Mg2+、NO3-、CO32- B.Na+、Al3+、Cl-、AlO2-
C.Ca2+、K+、Cl-、HCO3- D.NH4+、Fe3+、Ba2+、Cl-
22.某溶液中含有CH3COO-、SO42-、SO32-、HCO3-、CO32-等五种离子。将过量的Na2O2固体加入其中后,仍能大量存在的离子是
A.CH3COO-、SO42-、HCO3- B.SO42-、SO32-、CO32-
C.SO32-、HCO3-、SO42- D.CH3COO-、SO42-、CO32-
23.某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍为无色,则下列关于该溶液组成的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含SO32- ④可能含I-
A.①② B.①②③ C.①③ D.②③④
24.下列各组离子中能在水溶液中大量共存,且溶液显酸性的是( )
A.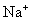 、
、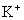 、
、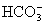 、
、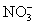 B.
B.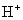 、
、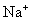 、
、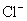 、
、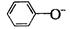
C.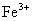 、
、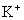 、
、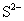 、
、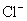 D.
D.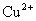 、
、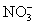 、
、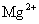 、
、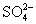
25.下列各组离子,在强碱性溶液中可以大量共存的是:
A.K+、Na+、HSO3-、Cl- B.Na+、Ba2+、AlO2-、NO3-
C.NH4+、K+、Cl-、NO3- D.K+、Na+、ClO-、S2-
26.25℃时,在水电离出的c(H+)=1×10-5mol/L的溶液中,一定能大量共存的是
A Al3+、NH4+、SO42-、Cl- B Mg2+、K+、SO42-、HCO3-
C K+、Na+、Cl-、SO42- D Ba2+、Cl-、Na+、PO43-
27.常温下,下列各组离子在制定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
28、在水溶液中能大量共存的一组是
A 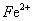
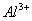
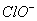
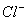 B
B 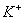
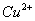
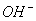
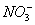
C 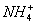
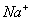
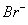
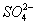 D
D 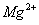
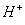
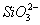
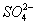
第二篇:离子大量共存规律总结
若题目限定溶液“无色”,则不含有色离子,即Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)等离子。若“透明”,则溶液不形成混浊或沉淀(与溶液有无颜色无关)。如Ag+与Cl-、Br-、
I-、SO42-;Ca2+与CO32-、SO42-;Ba2+与CO32-、SO32-、SO42-等在水溶液中会发生反应,有混浊或明显的沉淀生成,它们不能大量共存。
常见的叙述有强酸性溶液、PH=1的溶液、能使PH试纸变红的溶液、紫色石蕊试液呈红色的溶液、甲基橙呈红色的溶液、加入镁粉能放出氢气的溶液等。
若题目中限定溶液呈酸性,则溶液中有H+存在,其中不能大量含有OH-、弱酸根离子(如CO32-、SO32-、
S2-、F-、ClO-、CH3COO-、PO43-、AlO2-、SiO32-等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等)
常见的叙述有强碱性溶液、PH=14的溶液、能使PH试纸变蓝的溶液、红色石蕊试纸变蓝的溶液、酚酞呈红色的溶液、甲基橙呈黄色的溶液、加入铝粉反应后生成AlO2-的溶液、既能溶解Al(OH)3又能溶解H2SiO3的溶液等。
若题目中限定溶液呈碱性,则溶液中有OH-存在,其中不能大量含有H+、弱碱的阳离子(如NH4+、Mg2+、Ag+、Al3+、Cu2+、Fe2+、Fe3+等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等)。
若题目中出现这样的条件,则溶液中可能有H+存在,也可能有OH-存在,分析时要注意题目要求回答的是一定能大量共存(满足无论是与H+还是与OH-都不会反应)还是可能大量共存(只要满足与H+、 若题目中出现因发生氧化还原反应而不能大量共存这样的条件时,要考虑各离子组中是否存在强氧化性和强还原性的离子。如Fe3+与S2-、SO32-、HSO3-、I-;H+与S2O32-和S2-;MnO4-(H+)与Cl-;MnO4-(H+)、NO3-(H+)与Fe2+、S2-、HS-、SO32-、HSO3-、Br-、I-等不能大量共存。 OH-中的一种不会反应就可以)。
-
离子共存-总结
《离子共存》试讲教案说课部分:大家好,今天我和大家一起学习离子反应这个专题。离子反应这一块内容在高考中主要有两个考点一、离子共存的…
-
高考离子共存总结
1.复习重点(1)增加限制条件,如强酸性、无色透明、碱性、pH=1、甲基橙呈红色、发生氧化还原反应等。(2)定性中有定量,如“由水…
-
离子共存总结
离子共存(彭英)在溶液中离子是否大量共存的问题是一种常考的选择题型,由于题中条件变化多端,共存情况复杂,往往使不少学生判断失误。其…
-
离子共存总结
离子共存专题总结一、溶解度表二、离子不能共存所发生的几种反应1、复分解反应(1)有气体产生。如CO32-、SO32-、S2-、HC…
-
离子大量共存规律总结
发布时间:20xx-8-2611:28:25来源:网络转载作者:佚名点击量:114本文导读:有关溶液中离子能否共存问题是中学化学中…
-
离子共存问题总结
1.复习重点(1)增加限制条件,如强酸性、无色透明、碱性、pH=1、甲基橙呈红色、发生氧化还原反应等。+--10(2)定性中有定量…
-
离子能否大量共存问题的分析与判断
判断离子能否大量共存实际上就是判断离子之间能否反应,只要离子间相互反应,那么就不能大量共存,否则就能大量共存。下面讨论离子能否共存…
-
离子共存与离子反应方程式的书写判断规律总结
离子共存与离子反应方程式的书写判断(09)12.下列离子方程式正确的是A.向盐酸中滴加氨水:H++OH-=H2OB.Fe(OH)3…
-
离子大量共存规律总结
相关知识点:(一)、由于发生复分解反应,离子不能大量共存。1、有气体产生。如CO32-、S2-、HS-、HSO3-、等易挥发的弱酸…
-
高二化学离子共存专题总结
六、在指定条件下,判断溶液中不同的离子能否大量共存一、由于发生复分解反应,离子不能大量共存。1、离子间能反应生成难溶或微溶的物质,…
-
离子共存总结
离子共存专题总结一、溶解度表二、离子不能共存所发生的几种反应1、复分解反应(1)有气体产生。如CO32-、SO32-、S2-、HC…