离子大量共存规律总结
离子大量共存规律总结
· 发布时间:20##-8-26 11:28:25
· 来源:网络转载
· 作者:佚名
· 点击量:114
本文导读: 有关溶液中离子能否共存问题是中学化学中的常见问题。近几年高考几乎每年都设置判断离子共存问题的试题。--“好父母”教育咨询网是专业性家庭教育咨询网
有关溶液中离子能否共存问题是中学化学中的常见问题。近几年高考几乎每年都设置判断离子共存问题的试题。从历年高考中有关离子共存问题的难度上分析,这类问题都属于中等难度偏易题,但这类题的区分度都比较高。也就是说,题不难,但考生在这类题上能否得分差异较大。造成这种状况的原因,主要是考生在元素及其化合物知识的学习中,没有将众多的元素及其化合物知识统摄整理,使之网络化并进行有序的存储,因而在提取、再现、辨认时,或出现错误,或发生障碍,或不完整。也有知识掌握不完整,物质间相互反应的规律不清晰,在解决问题时缺乏信心等因素造成。
相关知识点:
(一)、由于发生复分解反应,离子不能大量共存。
1、有气体产生。如CO32-、S2-、HS-、HSO3-、等易挥发的弱酸的酸根与H+不能大量共存,主要是由于CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑。
2、有沉淀生成。按照溶解性表,如果两种离子结合能形成沉淀的,就不能大量共存。溶解性表,可总结成这么五句话:钾(K+)钠(Na+)硝(NO3-)铵(NH4+)溶,硫酸(SO42-)除钡(Ba2+)铅(Pb2+)(不溶),盐酸(Cl-)除银(Ag+)亚汞(Hg22+)(不溶),其他离子基本与碱同。如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-等大量共存主要是由于Ba2++CO32-=CaCO3↓、Ca2++SO42-=CaSO4(微溶);Cu2+、Fe3+等不能与OH-大量共存也是因为Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等。
3、有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO-等与H+不能大量共存,主要是由于OH-+H+=H2O、CH3COO-+H+=CH3COOH;一些酸式弱酸根不能与OH-大量共存是因为HCO3-+OH-=CO32-+H2O、HPO42-+OH-=PO43-+H2O、NH4++OH-=NH3·H2O等。
4、一些容易发生水解的离子,在溶液中的存在是有条件的。如AlO2-、S2-、CO32-、
C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。
如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
(二)、由于发生氧化还原反应,离子不能大量共存
1、具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如I-和Fe3+不能大量共存是由于2I-+2Fe3+=I2+2Fe2+。
2、在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如NO3-和I-在中性或碱性溶液中可以共存,但在有大量H+存在情况下则不能共存;SO32-和S2-在碱性条件下也可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能存在。
(三)、由于形成络合离子,离子不能大量共存
中学化学中还应注意有少数离子可形成络合离子而不能大量共存的情况。如Fe3+和
SCN-、C6H5O-,由于Fe3++SCN- [Fe(SCN)]2+等络合反应而不能大量共存。
(四)、能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存。例:Al3+和HCO3-,Al3+和S2-等。
解题指导
1.首先必须从化学基本理论和概念出发,搞清楚离子反应的规律和“离子共存”的条件。在中学化学中要求掌握的离子反应规律主要是离子间发生复分解反应和离子间发生氧化反应,以及在一定条件下一些微粒(离子、分子)可形成络合离子等。“离子共存”的条件是根据上述三个方面统筹考虑、比较、归纳整理而得出。因此解决“离子共存”问题可从离子间的反应规律入手,逐条梳理。
2.审题时应注意题中给出的附加条件
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
②有色离子MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)2+。
③MnO4-,NO3-等在酸性条件下具有强氧化性。
④S2O32-在酸性条件下发生氧化还原反应:
S2O32-+2H+=S↓+SO2↑+H2O
⑤注意题目要求“大量共存”还是“不能大量共存”。
3.审题时还应特别注意以下几点:
(1)注意溶液的酸性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4- 与Cl-在强酸性条件也不能共存;S2-与SO32-在钠、钾盐时可共存,但在酸性条件下则不能共存。
(2)酸式盐的含氢弱酸根离子不能与强碱(OH-)、强酸(H+)共存。如:
HCO3-+OH-=CO32-+H2O (HCO3-遇碱时进一步电离)
HCO3-+H+=CO2↑+H2O
例题分析:
[例1]下列各组中的离子,能在溶液中大量共存的是:
A.K+、Ag+、NO3-、Cl- B.Ba2+、Na+、CO32-、OH-
C.Mg2+、Ba2+、OH-、NO3- D.H+、K+、CO32-、SO42-
E.Al3+、Fe3+、SO42-、Cl- F.K+、H+、NH4+</< p>
第二篇:离子大量共存规律总结
离子大量共存规律总结
1. 离子共存问题是离子反应条件
所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2、熟记常考离子的性质
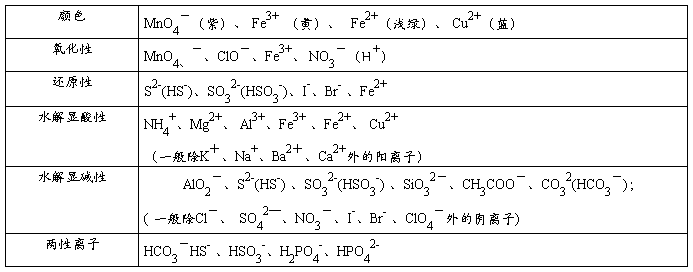
注:“两性离子”指既能与酸反应又能与碱反应的离子,一般多元弱酸的酸式酸根离子
3、离子间通常发生四种类型的反应,能互反应的离子不能大量共存。
(1)复分解反应
①、有沉淀生成。如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-等大量共存主要是由于Ba2++CO32-=CaCO3↓;Cu2+、Fe3+等不能与OH-大量共存也是因为Cu2++2OH-=Cu(OH)2↓, Fe3++3OH-=Fe(OH)3↓等。
②有气体产生。如CO32-、S2-、HS-、HSO3-、等易挥发的弱酸的酸根与H+不能大量共存,主要是由于CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑。
③有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-( 一般除Cl-、 SO42—、 NO3-、I-、Br- 、ClO4-外的阴离子)等与H+不能大量共存,主要是由于OH-+H+=H2O、CH3COO-+H+=CH3COOH;一些酸式弱酸根不能与OH-大量共存是因为HCO3-+OH-=CO32-+H2O、HPO42-+OH-=PO43-+H2O、NH4++OH-=NH3·H2O等。
(2)、发生氧化还原反应:具有较强还原性的离子不能与具有较强氧化性的离子大量共存
常见的氧化性离子:MnO4、-、ClO-、Fe3+、NO3-(H+)
常见的还原性离子:S2-(HS-)、SO32-(HSO3-)、I-、Br-、 Fe2+
注:Fe3+与Fe2+、 Br-能大量共存
(3)发生双水解反应:能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存。
常见的双水解:①Al3+、Fe3+和CO32(HCO3-)、S2-(HS-)、AlO2-、ClO-等
②NH4+和SiO32-、AlO2-
(4)络合反应:如Fe3+和SCN-、C6H5O-,由于Fe3++SCN- [Fe(SCN)]2+等络合反应而不能大量共存。
[Fe(SCN)]2+等络合反应而不能大量共存。
4、审题时应注意题中给出的附加条件和隐含条件。
(1)一色:溶液的颜色。
溶液无色时,则溶液中肯定没有有色离子存在。有色离子MnO4-,Fe3+,Fe2+,Cu2
(2)二性:溶液的酸性、碱性。

(3)三特殊:注意三种特殊情况
①注意溶液的酸性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4- 与Cl-在强酸性条件也不能共存; S2O32-在酸性条件下发生氧化还原反应,不能共存:S2O32-+2H+=S↓+SO2↑+H2O
②HCO3-与AlO2-发生双水解,不能大量共存。
③NH4+和CO32、HCO3-、CH3COO-等,虽然能发生双水解,但总的水解程度较小,因此能大量共存。
(4)注意题目要求“一定能大量共存”还是“可能大量共存”;“能大量共存”还是“不能大量共存”。
离子共存习题
1.某无色透明的溶液,在pH=0和pH=14的条件下都能大量共存的是( )
A.Fe2+、K+、SO42-、NO3- B.Mg2+ 、NH4+、SO42-、Cl-
C.Na+、K+、SO42-、NO3- D.Ba2+ 、Na+ 、MnO4- 、SO42-
2.(双选)下列澄清透明的溶液中,可能大量共存的离子组是
A.[Ag(NH3)2]+、K+、OH-、NO3- B.Fe3+、NH4+、Cl-、I-
C.H+、Al3+、SO42-、F- D.NH4+、Na+、Cu2+、Cl-
3.下列离子在溶液中因发生氧化还原反应而不能大量共存的是 ( )
A.H3O+、NO3-、Fe2+、Na+ B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、OH-
4.某溶液中加入铝粉有氢气产生,该溶液中一定可以大量共存的离子组是( )
A.Na+、NO3-、Cl-、SO42- B.Na+、K+、Ba2+、HCO3-
C.Fe3+、H+、SO42-、Cl- D.Na+、K+、Cl-、SO42-
5.常温下,由水电离生成的c(H+)=10-12 mol·L-1的某溶液中,一定不能大量共存的离子组是( )
A.Na+、Fe3+、NO3-、SO42- B.K+、AlO2-、CO32-、Cl-
C.Na+、K+、Cl-、HSO3- D.Na+、CH3COO-、C6H5O-、OH-
6.在室温下,某无色透明溶液中由水电离出来的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.Cu2+、Cl-、SO42- 、K+ D.SiO32-、SO32-、Na+、Cl-
7.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是
A.NH4+、Cu2+、Cl-、NO3- B.K+、Na+、SO32-、S2-
C.K+、Na+、AlO2-、SO42- D.Ba2+、Fe2+、NO3-、Br-
8(双选).下列各组离子在碱性条件下可以大量共存,而在强酸性条件下不能大量其存的是
A.Ca2+、Fe3+、NO3-、Cl- B.K+、Mg2+、HCO3-、SO42-
C.Na+、K+、S2-、SO32- D.Ba2+、Na+、I一、NO3-
9.下列各组离子一定能大量共存的是( )
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、AlO2—、CO32—
C.在c(H+)=10—13 mol/L的溶液中:NH4+、Al3+、SO42—、NO3—
D.在pH=1的溶液中:K+、Fe2+、Cl—、NO3—
10.下列各组无色溶液的离子组在pH=l时能大量共存的是
A.NH4+、C1-、Mg2+、SO42- B.A13+、Cu2+、SO42-、C1-
C.Ba2+、K+、NO3-、OH- D.Ca2+、Na+、C1-、A1O2-
11.下列各种情况下,溶液中可能大量存在的离子组是
A.使pH试纸呈红色的溶液中:I-、Cl-、NO3-、Na+
B.澄清透明的无色溶液中:K+、Mg2+、NO3-、MnO4-
C.在c(H+)/c(OH-)=1×1013的溶液中:NH4+、Ca2+、C1-、K+
D.含有较多的Al3+的溶液中:K+、Ca2+、ClO-、Cl-
12.在给定的四种溶液中,各离子能大量共存的是
A.滴加石蕊试液显红色的溶液: Fe3+、NH4+、Cl-、I-
B.能使pH试纸变为蓝色的溶液: Na+、CO32-、NO3-、SO32-
C.含有大量H+的无色溶液: Na+、Fe3+、NO3-、MnO4-
D.所含溶质为NaNO3的溶液: K+、HSO4-、C1-、S2-
13.常温下,下列各组离子在指定环境下能大量共存的是
A.pH=l的溶液中:Na+、K+、SO32-、MnO4-
B.pH=7的溶液中:Na+、A13+、Cl-、SO42-
C.pH>12的溶液中:Na+、K+、SO42-、AlO2-
D.pH=0的溶液中: Na+、K+、NO3-、ClO-
14.(双选)某无色溶液与NH4HCO3作用能产生气体(可加热),此溶液中可能大量共存的离子组是
A. Mg2+、H+、Zn2+、SO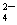 B.Na+、Ba2+、OH
B.Na+、Ba2+、OH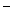 、SO
、SO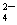
C.MnO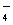 、K+、H+、SO
、K+、H+、SO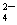 D.K+、NO
D.K+、NO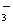 、OH-、Na+
、OH-、Na+
15.某溶液能使红色的石蕊试纸先变蓝色后褪色,则该溶液中可能大量共存的离子组是
A.K+、I—、AlO2—、MnO4— B.Na+、S2—、NO3—、SO42—
C.Al3+、NH4+、NO3—、F— D.K+、Cl—、ClO—、CO32—
16.在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C. c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
17.(双选)下列各组离子能大量共存,当溶液中c(H+)=10-1mol/L时,有气体产生;而当溶液中
c(H+)=10-13mol/L时,又能生成沉淀。该组离子可能是
A.Na+、Cu2+、NO3-、CO32- B.Ba2+、K+、Cl-、HCO3—
C.Fe2+、Na+、SO42-、NO3- D.Mg2+ 、NH4+、SO42-、Cl—
18.在pH=1的溶液中,大量存在着的阳离子是NH4+、Mg2+、Al3+、Fe2+,则溶液中还可能大量存在的阴离子是
A.Cl— B.ClO— C.HCO3— D.NO3—
19.已知pH=1的某溶液中存在较多的Ba2+、NO3-,则该溶液中还可能大量存在的离子组是
A.Fe3+、F-、Cl- B.Mg2+、SO42-、Br-
C.Mg2+、Cl-、Fe2+ D.Na+、NH4+、Cu2+
20.向某溶液里加入过量的氨水或过量的氢氧化钠溶液,均有沉淀产生;若加入铁粉或铜粉,溶液的质量都增加,则该溶液里一定含有下列离子中的
A.Al3+ B.Fe2+ C.Fe3+ D.Cu2+
21.(双选)下列各组离子能大量共存于同一溶液中,且加入少量NaOH溶液或适量稀H2SO4时,都能产生沉淀的是
A.Ba2+、Mg2+、NO3-、CO32- B.Na+、Al3+、Cl-、AlO2-
C.Ca2+、K+、Cl-、HCO3- D.NH4+、Fe3+、Ba2+、Cl-
22.某溶液中含有CH3COO-、SO42-、SO32-、HCO3-、CO32-等五种离子。将过量的Na2O2固体加入其中后,仍能大量存在的离子是
A.CH3COO-、SO42-、HCO3- B.SO42-、SO32-、CO32-
C.SO32-、HCO3-、SO42- D.CH3COO-、SO42-、CO32-
23.某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍为无色,则下列关于该溶液组成的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含SO32- ④可能含I-
A.①② B.①②③ C.①③ D.②③④
24.下列各组离子中能在水溶液中大量共存,且溶液显酸性的是( )
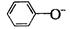
A.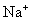 、
、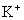 、
、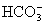 、
、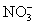 B.
B.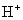 、
、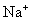 、
、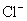 、
、
C.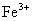 、
、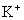 、
、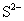 、
、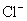 D.
D.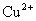 、
、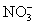 、
、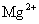 、
、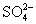
25.下列各组离子,在强碱性溶液中可以大量共存的是:
A.K+、Na+、HSO3-、Cl- B.Na+、Ba2+、AlO2-、NO3-
C.NH4+、K+、Cl-、NO3- D.K+、Na+、ClO-、S2-
26.25℃时,在水电离出的c(H+)=1×10-5mol/L的溶液中,一定能大量共存的是
A Al3+、NH4+、SO42-、Cl- B Mg2+、K+、SO42-、HCO3-
C K+、Na+、Cl-、SO42- D Ba2+、Cl-、Na+、PO43-
27.常温下,下列各组离子在制定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
28、在水溶液中能大量共存的一组是
A 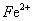
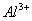
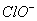
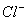 B
B 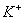
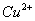
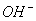
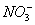
C 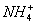
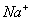
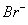
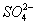 D
D 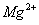
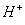
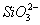
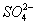
-
离子共存-总结
《离子共存》试讲教案说课部分:大家好,今天我和大家一起学习离子反应这个专题。离子反应这一块内容在高考中主要有两个考点一、离子共存的…
-
高考离子共存总结
1.复习重点(1)增加限制条件,如强酸性、无色透明、碱性、pH=1、甲基橙呈红色、发生氧化还原反应等。(2)定性中有定量,如“由水…
-
离子共存总结
离子共存(彭英)在溶液中离子是否大量共存的问题是一种常考的选择题型,由于题中条件变化多端,共存情况复杂,往往使不少学生判断失误。其…
-
离子共存总结
离子共存专题总结一、溶解度表二、离子不能共存所发生的几种反应1、复分解反应(1)有气体产生。如CO32-、SO32-、S2-、HC…
-
离子大量共存规律总结
发布时间:20xx-8-2611:28:25来源:网络转载作者:佚名点击量:114本文导读:有关溶液中离子能否共存问题是中学化学中…
-
离子共存问题总结
1.复习重点(1)增加限制条件,如强酸性、无色透明、碱性、pH=1、甲基橙呈红色、发生氧化还原反应等。+--10(2)定性中有定量…
-
离子能否大量共存问题的分析与判断
判断离子能否大量共存实际上就是判断离子之间能否反应,只要离子间相互反应,那么就不能大量共存,否则就能大量共存。下面讨论离子能否共存…
-
离子共存与离子反应方程式的书写判断规律总结
离子共存与离子反应方程式的书写判断(09)12.下列离子方程式正确的是A.向盐酸中滴加氨水:H++OH-=H2OB.Fe(OH)3…
-
离子大量共存规律总结
1.离子共存问题是离子反应条件所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共…
-
离子大量共存规律总结
相关知识点:(一)、由于发生复分解反应,离子不能大量共存。1、有气体产生。如CO32-、S2-、HS-、HSO3-、等易挥发的弱酸…
-
高考离子共存总结
1.复习重点(1)增加限制条件,如强酸性、无色透明、碱性、pH=1、甲基橙呈红色、发生氧化还原反应等。(2)定性中有定量,如“由水…