动物细胞培养助教总结报告
动物细胞培养助教总结报告
李 骥 3009213008
一、实验目的
1、了解动物细胞培养的概念与分类
2、熟悉无菌操作的步骤以及技巧
二、实验原理
1.动物细胞培养 animal cell culture
动物细胞培养就是从动物机体中取出相关的组织,将它分散成单个细胞(使用胰蛋白酶或胶原蛋白酶)然后,放在适宜的培养基中,让这些细胞生长和增殖。
2.原代培养 primary culture
原代培养是指直接从机体取下细胞、组织和器官后立即进行培养。因此,较为严格地说是指成功传代之前的培养,此时的细胞保持原有细胞的基本性质,如果是正常细胞,仍然保留二倍体数。但实际上,通常把第一代至第十代以内的培养细胞统称为原代细胞培养。最常用的原代培养有组织块培养和分散细胞培养。
3.传代培养 subculture
当原代培养成功以后,随着培养时间的延长和细胞不断分裂,一则细胞之间相互接触而发生接触性抑制,生长速度减慢甚至停止;另一方面也会因营养物不足和代谢物积累而不利于生长或发生中毒。此时就需要将培养物分割成小的部分,重新接种到另外的培养器皿(瓶)内,再进行培养。这个过程就称为传代或者再培养。对单层培养而言,80%汇合或刚汇合的细胞是较理想的传代阶段。
4.培养基 Medium
培养基是供微生物、植物和动物组织生长和维持用的人工配制的养料,一般都含有碳水化合物、含氮物质、无机盐(包括微量元素)以及维生素和水等。有的培养基还含有抗菌素和色素,用于单种微生物培养和鉴定。
5.无菌操作
接种是细胞培养中极其重要的一环。接种过程是一个严格的无菌操作过程,操作不慎很容易引起污染。接种通常在超净工作台内进行,由于空气的高效过滤和一定的气流速度吹动,工作台面上能保持一完全无菌的环境。如没有超净工作台,可在接种箱内进行。
三、仪器和药品
仪器:酒精灯,培养皿x2x,手术剪,手术镊x2,漏斗,玻璃离心管,培养瓶,胶头滴管x2,一次性注射器,烧杯x2,37℃恒温箱,离心机
试剂:DMEM细胞培养液(pH约为7.4),DMEM细胞培养液(含血清),胰蛋白酶
*DMEM细胞培养液
DMEM是一种含各种氨基酸和葡萄糖的培养基,是在MEM培养基的基础上研制的。与MEM比较增加了各种成分用量,同时又分为高糖型(低于4500g/L)和低糖型(低于1000g/L)。高糖型有利于细胞停泊于一个位置生长,适于生长较快、附着较困难肿瘤细胞等。
四、实验步骤
1、剪碎
从鸡蛋内取出鸡胚,在培养皿中去掉头和四肢,将躯体剪成3-4块,用不含血清的培养液清洗,然后转移至另一个培养皿,剪碎至1mm2的小块,再清洗,转移至玻璃离心管
2、离心
将剪碎的组织和无血清培养液加入玻璃离心管后,用相同的离心管装入自来水进行质量配平,供离心用。配平标准为天平的指针稳定在标盘某刻度,并非必须要在正中间。此次离心时间约为3分钟,速度为2000/min 左右
3、消化
离心后,倒出上层清夜(无菌操作)。加入胰蛋白酶约5ml,在37度恒温箱内进行消化。消化时长约为15min,每5分钟振摇一次,发现试管内组织微微泛白,即可停止,然后直接进行离心。3000/min,3mins
4、过滤装瓶
离心后,弃去上层清夜(可留部分),加入2-3ml含血清的培养液,吹打,后加入含血清培养液至5-6ml,进行过滤(无菌操作)。贴标签,恒温培养
五、预实验情况
1、熟悉实验具体内容
我组提前两周进入实验室进行预实验,在李老师简单介绍并进行了操作演示后我们开始查阅资料,了解细胞培养的具体步骤,操作方法,以及所需的仪器和药品,并开始着手配制培养基和准备仪器。
2、实验前准备
卖鸡蛋,送恒温箱保存;清洗仪器(离心管,剪刀镊子等),10遍自来水洗,后5遍蒸馏水洗→烘干→高温高压灭菌(蒸)1h左右→超净台紫外线照射20min→开始实验
3、遇到的问题
(1)配液时胰蛋白酶不溶
解决过程:①咨询学长学姐,发现超声助溶效果并不好。②我们尝试搅拌子搅拌助溶,经过一夜的搅拌,出现白色絮状沉积,振摇后散开,没有溶解。③咨询李老师后尝试缓慢加入胰蛋白酶粉末,溶解效果有所提高,但胰蛋白酶的活性很不好。
最终解决办法:李老师直接购买了液体胰蛋白酶,方便实用且活性很好。
这个故事告诉我们,光花钱是做不好实验的,但是不花钱更是做不好实验的。。。。。。
(2)培养基问题
培养基在配置前是粉末状的,第一次使用的培养基是含酚红的1640,但由于量不够,又补充了一些不含酚红的1640。最后培养基的颜色成橘红色。
而第二次配液时,1640已全部用完,我组改用不含酚红的DMEM培养基。鉴于二班组按照理论值加入酚红后培养基过红影响观察,且考虑到酚红是用来鉴别酸碱性的,定性不定量,所以我组酚红并未定量加入,而是采取边观察边加入的方法,保证培养基成色最好。
(3)消化时长
预实验时发现用胰蛋白酶消化组织并离心后剩余的液体常成鼻涕状,不易分离上清液。查找资料后得知,这是消化过度造成的影响。
而后我组在做实验时,精确控制消化时长,静置为15分钟,开摇床为10分钟。并同时目视监控,一旦发现组织已泛白即停止消化,保证后续操作的顺利进行。效果较好。
PS:在后期的实验中,我发现胰蛋白酶的活性随着购买时间的增长有明显的降低,所以对胰蛋白酶的活性的探究应该注明购买时长。
(4)关于吹打的操作
由于开始做实验时很多操作很不熟悉,吹打时多使用灭菌枪头。但后来发现用灭菌枪头的两个弊端。①吸培养液时,培养液容易因吸取过快或倾斜枪体而接触枪口导致污染。②枪头嘴太小,无法吸入组织块,吹打很不顺利。
因此我们分两次改进了仪器,第一次将1000μL的枪改为5000μL的枪,并用剪刀剪去枪头尖端,使枪嘴粗大,保证在不出现错误操作的前提下不会有污染的发生。第二次将无菌枪头彻底改为带棉塞的胶头滴管,效果较好。胶头滴管灭菌彻底,吸收顺畅,便于吹打。
唯一的缺点就是准备时较麻烦,且使用时要先上胶头,对操作者要求较高。
4、录制视频
我和小丽分别录制了实验操作全过程的视频,但是后来因为觉得视频太过抽象,而且印象不深,没有重点,经商议,我们决定现场演示。
5、预实验总结
预实验阶段共买蛋1次,配制培养基2次,取鸡胚4只。每次实验均可以成功地观察到细胞贴壁现象,其中,最后一次实验由高晓丽同学观察到了组织块贴壁生长的现象,并以此来对大家进行要求(后来证明其实并不是组织块贴壁)。
六、带实验情况
1、实验前准备
买蛋(感谢李老师),灌装酒精灯12个,清洗并灭菌仪器12套,配制充足培养基并过滤,倒置相差显微镜的连接,实验当天早晨紫外杀菌
2、实验时情况
情况众多,比较顺利
由于条件限制,我们的操作环境无法保证绝对无菌,不过因为培养基中加入了双抗的缘故,在整个实验中如果没有重大的操作失误是很难长菌的。
但是由于小鸡出壳的画面比较限制级,还是有很多女生没有忍住发出了“啊”和“呃”一类的呼喊,其实在无菌操作的时候是不允许说话的…
另外因为所有人都是第一次接触活体动物实验,而且主刀的大部分是男生,力气比较大,又有些激动…导致有些鸡胚在还没有出壳时就被分尸了,之后出壳过程花了很长时间。空气中暴露时间越长,就越容易染菌,还望大家以后注意。
这个故事告诉我们,人生无论遇到什么事情,都要保证内心的平静,安详,与矜持
3、实验结果观察
由于我和小丽是一步一步带着大家做的,所以除了极个别组出现了一些小问题外,大部分组的细胞都顺利贴壁,且长势良好。
然而绝大部分组的组织块体积都过大,很少有人按要求剪碎至1mm³后放入培养瓶。导致观察时出现了大片的阴影,很难寻找细胞。
不过我还是顺利帮大家找到了组织块爬出来的细胞,虽然后来证明那些并不是细胞贴壁生长…囧……


七、创新实验初期
1、创新
本组认为,依靠本科生实验室的条件和我们的自身实力所能做到的创新实验大致上可以分为几类:①对于既有实验方法的改进(如搅拌溶解改为超声溶解等)②对实验原理的优化(如合成阿司匹林时反应路线的调整)③对现有高新技术的重现(如质粒DNA的提取等)
2、思考过程
怎样制造创新点→回想组织块培养并未成功,希望可以完善→本次实验培养的细胞比较混杂,希望可以提纯→提纯后想要发挥纯化细胞的作用,进行细胞合成制成单克隆抗体→从培养普通细胞发展到特殊细胞,如癌细胞→癌细胞很好养,既然要研究癌细胞主要是研究杀灭癌细胞的有效药→养过二倍体后尝试单倍体
3、创新内容
因此,我组从中选取了两项进行实验创新,即
①原理优化:
组织块培养法的优化
②高新技术
细胞的无限稀释克隆
细胞融合
癌细胞的抗药性实验
③纯探究性实验
单倍体的体外培养
*由我完成的部分用红色标出
八、创新实验中期
(一)组织块培养法的优化
1、前期思考
过程:为了探究原来的方法是否有效,我们选择在刚接种组织块时作对比观察。一天后再观察。
实验结果:刚接种后即可观察到所谓的细胞贴壁生长现象,一天后再观察保持原样。推测那些爬出的“细胞”应为组织块的肌肉纤维,并非真正的组织块贴壁生长。
实验难点:如何使固定并牢固接触培养瓶底部
实验时经常和细菌组的同学聊天,偶然的机会想到了细菌组划板时使用的琼脂培养基。由于琼脂有粘性,又可以溶有养料,适于细胞培养,故尝试使用细菌培养基。。
2、实验过程
(1)实验一
实验准备:①鸡蛋仪器等准备②配制不含其它成分的纯琼脂,经蒸煮消毒后待用。
实验过程:前期操作同原实验,将鸡胚剪碎并清洗后,准备培养瓶。
瓶①预先加入一层薄薄的琼脂,以恰好覆盖住瓶底为合适,瓶②不做任何预处理。当瓶①中的琼脂基本晾干凝固后,向两瓶内加入4块组织块,同时向瓶②中加入液体琼脂,使组织块悬浮于琼脂中。待两瓶中的琼脂全部凝固后,加入适量培养基,培养36小时后观察。
区分:瓶①:先加琼脂,再加组织块,最后加培养基
瓶②:先加组织块,再加琼脂,最后加培养基
目的:无论哪种做法目的都是使组织块可以固定在瓶底,使组织块更好地贴壁生长
结果观察:两瓶中的组织块均已固定,其中瓶①的组织块嵌在琼脂表面,瓶②的组织块嵌入琼脂中,类似细胞膜上蛋白质的位置。但两瓶组织块均未贴壁生长。
推测原因:瓶①:接触面不够硬,若要组织块贴壁生长,则需要坚硬平滑的平面为依靠。
瓶②:接触不到任何面,没有生长空间
结果:琼脂培养法失败
(2)实验二
新的设计:根据失败的教训我们有了新的想法,既然目的是使组织块贴在培养瓶底部,那我们就让它直接贴上好了。

新的实验:前期操作同原实验,将鸡胚剪碎并清洗后,同时向瓶①和瓶②内加入4块组织块,要求组织块之间要有一定距离。同时向瓶②中加入极少量培养基。
将两瓶放入37℃恒温箱保存5小时后再进行处理。
五小时后,组织块都已粘附在培养瓶底部,此时加入适量培养基,缓慢将培养瓶放入恒温箱,36小时后观察。(此方法灵感来源于上图的反转干固法)
结果观察:两瓶中的组织块均已固定,且均已贴壁生长
瓶②(加入少量培养基)的操作是避免细胞失水,但发现如果时间控制较好,瓶①(未加入培养基)也可避免失水现象发生。
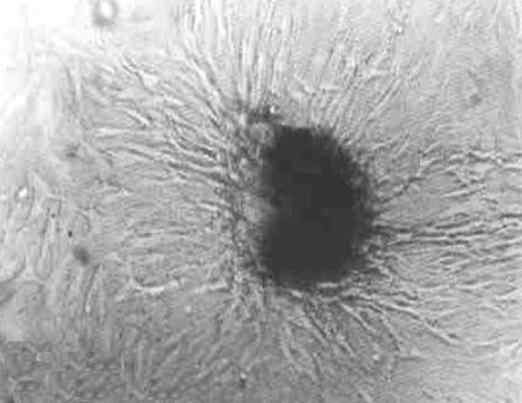
可以发现此时的组织块贴壁生长和之前的有明显的不同
(二)癌细胞的抗药性实验
1、前期思考
实验构想:个人觉得细胞培养是一个很成熟的生物技术,纠结于研究培养基不加血清的影响或者改变培养基pH等的影响已经意义不大,其结果显而易见,势必要劣于原来的方案,因为原方案与人体体内环境最为相似。
因此我想尝试一些新的想法,或者说想做一些结果出来后真的对其他人有帮助的实验。而非执着于优化某一流程。所以想到了癌细胞培养,和癌细胞抗药性的实验。
2、实验过程
实验准备:①癌细胞(人体肺癌细胞、来自常志静)
②植物药粗提物与精提物各11种(来自张文静学姐—陈海霞老师实验室
③96孔板(李振莉老师提供)
④一次性塑料培养瓶(来自常志静学姐)
⑤其他实验器材,如微量移液器和枪头等(公用实验室、自己准备)
⑥MTT试剂(常志静学姐小组友情提供)
(1)前期
拿到癌细胞后→培养24h→更换新鲜培养基→培养24h→传代至三瓶→培养24h→更换新鲜培养基→培养24h→上板
遇到问题
1、消化问题
贴壁后的癌细胞消化时间相当长,与对面实验室的半分钟相比,本实验消化五分钟后才可见癌细胞脱落。考虑是由于胰蛋白酶放置时间过长,活性降低导致。
目前没有较好的解决办法。

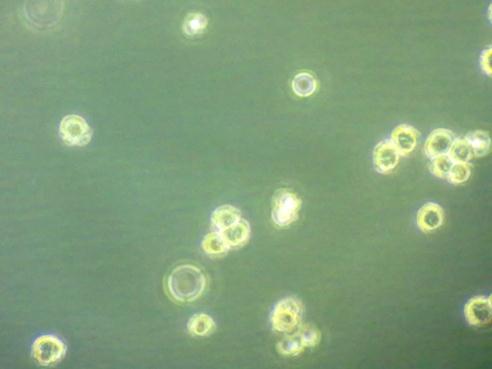
图为同样消化半分钟,不同实验室细胞的对比(上图为本实验,下图为常志静学姐的实验)。可以看出,同一株癌细胞分化出的细胞消化差别如此之大,可以说明应该是胰蛋白酶的问题
2、癌细胞长势
虽同时在对数生长期传代,但传代后长势相对差异较大,传代36h后,四瓶瓶底已铺满,两瓶还正在贴壁生长。
考虑加入细胞的量不同会对细胞生长周期造成影响。例如加入过少细胞不利于成活,加入过多细胞不利于贴壁等。
解决办法,消化离心后,充分吹打,并等量加至各个培养瓶。
(2)中期
选取长势良好的培养瓶→消化离心→弃去上清液加入新鲜培养基→充分吹打,混匀→取40μL进行细胞计数→其余上板(96孔板,上60孔)→恒温培养24h→更换新鲜培养基→恒温培养24h→上药
上药:我们共有11个样品,其中包含黄酮,皂苷等抗癌成分。为了可以充分了解最适药物浓度。我们初期设想为每种药品设置5个浓度梯度,3个时间梯度,和2个平行组。共11x5x3x3=495孔。鉴于数量太大,我们将浓度梯度改为三个。分别是0.1μg/mL,1μg/mL,10μg/mL
遇到问题
1、药物溶解
样品中的大部分中药有效成分的都是不溶于水的,一般我们用乙醇或DMSO溶解。但在溶解过程中发现加入适量DMSO助溶且药物完全溶解后,再加入培养基出现浑浊,推测为药物析出,此时进行无菌过滤势必要造成药物的损失。这时我们分别采用了微热,超声助溶等方法,由于药物储备液(而非稀释后的待用药液)浓度较高,均没有很好的效果。
最后决定加过量DMSO,其对细胞产生的影响我们会同步记录在其中。
另一种想法是在配置储备液时并不进行无菌过滤,而当加药品时经稀释后再进行过滤。但由于不能确定目视不可见的药物析出是否存在于药液中,为了避免风险,并没有采纳这一方法。
2、细胞染菌
由于是公共实验室,所以37℃恒温箱是很多人共用的。以至于出现了细菌和细胞养在同一个箱子里的神奇一幕。当时一个学长听说我们之前的细胞没染过菌之后说,这简直就是个奇迹!
不过由于以前使用的仪器都是密封的如离心管、培养瓶等,隔绝细菌的能力很强。但这次使用的96孔板板盖只是轻轻覆在上面,非常容易飞进细菌。为了避免染菌我们已经舍弃了周围一圈孔,并在上板后用封口纸密封,但是我们上的前两块板,一块全部染菌,一块仅正中间5个孔幸免于难。
解决办法:经过跟李老师商讨后,得到了用灭菌后的饭盒创造一个无菌小环境的建议,颇为可行,这也是目前阶段最好的办法了。
(3)后期
上药后恒温培养→24h后MTT检测→48h后MTT检测→72h后MTT检测→绘图→得出结果
该实验在还差最后一步时由于种种原因提前宣告结束,但是我在八月份重启了一个类似的课题,下文将详细讲解
(三)单倍体(精子)的体外培养
前言:看了前面的文字大家应该已经了解我的实验重点就在癌细胞的植物药拮抗作用上了,精子的体外培养对于我来说完全是一个实验之余自娱自乐的事情。不过,由于没有查到关于精子体外培养的资料(一般都是冻存),所以这是一个完全自己探索的领域。
实验准备:①新鲜活性精子(自备)
②显微镜
③载玻片
④各种浓度酸碱及生理盐水
⑤细胞培养的相关仪器
活性判别标准:
流动性(自定)
由于精细胞实在太小,无法判别形态特征,因此以其流动性为判别标准。精细胞由视野左移动到视野右,在最具活力时需要2秒左右,这个时间随着体外放置时间的延长而延长。
标尺:加入精子后,培养瓶恒温培养,48h后失去活性。
实验过程:
①分离,加入离心试管后加少量生理盐水,3000r/min离心5分钟,弃去上清液,加五毫升生理盐水,分装3瓶。其中一瓶加入1MHCL,10%,一瓶加入1MNaOH,10%,一瓶空白。三瓶均恒温培养。
观察发现,酸碱组在10分钟后即出现反应,精子活力明显下降,30后完全丧失活动能力。生理盐水组可以存活15-20小时左右。
②分为两组,一组分离后分装2瓶,分别加入带血清和不带血清的培养基,另有一组不做离心进行对照。
结果发现,带血清组存活72h,无血清组存活40h,原装组存活48h。由此知,精子在体外存活也需要摄取养分。而最大限度模拟人体内环境还是有利于精子存活的。
③上网查资料知,精子在女性体内(微碱性)可存活三至四天,因此通过在培养基中加入NaHCO3调节pH获得了pH为7.5,7.7,8.0三组培养基。培养后发现,存活时间几乎都为72小时,很难再延长。由此知人体内环境有很多成分和影响因素还不为人所知,如果想百分之百模拟还需要大量的实验。
实验结果:
经实验可知,精子在体外长时间存活几乎不可能,最可靠的方法就是冻存。若是想要体外存活,原封不动或加入培养基是最好的方法,当然要保证温度和湿度。不过由于不同批次的精子活力略有差异,所以不同实验组的结果没有横向可比性。
九、创新实验后期
我很有幸地在暑假来到了天津中医药大学科研中心进行实习。在做了数天药分实验后,被分到了生化组,两天后领到了一个课题。由于这个课题和我之前做的实验非常类似,可以说是之前实验的一个延续。所以我参与其中进行了课题中的部分相关实验,实验结果很好并得到了老师的肯定。
附相关实验内容
续断属基于雌激素受体通路的活性筛选
目的:从雌激素受体(ER)的作用途径进行续断的活性筛选。方法:将中药材续断中分离得到的单体配成不同浓度的溶液作用于MCF-7细胞,检测细胞增殖率;将含有ERE原件的外源基因通过脂质体导入Hela细胞,加药作用后通过检测Firefly luciferase/ Renila luciferase的比值来判断药物是否激活了ERs。
实验提取物共有4种,我负责了其中两种的活性测定
材料与方法
1 实验材料
1.1 细胞株来源
Hela细胞(人宫颈癌细胞)购自上海细胞生物研究所。
MCF-7(ERa+, ERb+)乳腺癌细胞株购自上海细胞生物研究所。
1.2 主要试剂

1.3 受试药物(前期系统分离得到的单体成分)
表2-1 从续断中分离得到的单体成分

以上单体成分纯度均为95%以上。
红色为我负责的化合物
1.4 主要仪器
多功能读板机 Felex station 3 美国MD 公司
小型台式离心机 Microfuge 22R 美国Beckman公司
台式冷冻离心机 64R 美国Beckman公司
小型离心机 Minispin 德国Eppendorf公司
CO2培养箱 3111型 美国Thermo公司
-80℃低温冰箱 MDF-382E 日本Sanyo公司
-40℃低温冰箱 MDF-U5410 日本Sanyo公司
2 实验方法
2.1 细胞培养
细胞从液氮中取出后,直接放入37~40℃温水中,迅速摇动并不断观察融化情况,避免温度过高使细胞损伤。然后在无菌条件下,吸出细胞冻存液,移至离心管并加入DMEM全培养液。800~1000rpm离心,去除上清液,再重复用培养液洗涤一次。加入足量培养液轻轻吹打成为细胞悬液,移入培养瓶(接种密度为5×105/ml),置于5%CO2、95%空气、37℃、饱和湿度的培养箱内培养,24h后更换培养液继续培养。
根据已有的细胞倍增时间进行细胞消化和传代,待细胞处于对数生长期或接近铺满整个培养瓶底面后,吸弃瓶内培养液,加入0.25%的胰蛋白酶液和0.02%的EDTA液,之后轻轻摇动培养瓶,使消化液浸过细胞表面,置于37℃培养箱,消化1分钟后将培养瓶放置在倒置显微镜下进行观察,发现胞质回缩,细胞间隙增大后,立即终止消化,吸弃消化液,加入全培养液,用弯头吸管按顺序反复吹打贴壁细胞,使细胞脱离瓶壁,形成单细胞悬液。细胞计数后,分别接种在3~5个新的培养瓶内,置于5%CO2、95%空气、37℃、饱和湿度的培养箱内继续培养。
2.2. 质粒提取(未参与)
2.3 细胞转染及结果测定(未参与)
2.4 细胞增殖实验(E-screen实验)
2.4.1细胞培养及药物处理
MCF-7细胞以含10%FBS的有酚红DMEM培养基常规培养,至80%融合时用0.25%胰酶消化,以104个细胞每孔接种于96孔板。置于37℃,5%CO2培养箱中培养24 h 后,细胞贴壁良好,铺展生长。此时吸去10%CS-FBS无酚红DMEM培养液,加入1%CS-FBS无酚红DMEM培养液同步化,预培养12h,以增加细胞对雌激素样物质的敏感性。更新实验培养液,并同时加入不同浓度药物。同时每块96孔板都设溶剂对照组(0.1% DMSO)、E2组(0.01μM)、E2(0.01μM)+ICI(0.1μM)组、药物各浓度组(10-5M、10-6M、10-7M)、以及药物+ICI(0.1μM)组,培养24h。
2.4.2细胞增殖率检测
MTT法检测细胞增殖率。按说明书操作,吸去96孔板培养液,每孔避光加入0.5mg/mlMTT溶液(PBS为溶剂)100μl,置于37℃,5%CO2培养箱中培养4 h 后每孔加入150μlDMSO,震荡使紫色结晶溶解,选择570nm 波长,在多功能读板机上测定各孔光吸收值,计算各组细胞相对增殖率(relative proliferative effect, RPE)。
RPE= (ODsample/ODcontrol) ×100%
实验结果
原图较大,看不清楚可以拉伸
皂苷实验结果,血药浓度为10-6时对细胞生长的促进作用最强

次苷实验结果,血药浓度为10-6时对细胞生长的促进作用最强

致谢
半年的实验过程一转眼就结束了,在这个完整的实验过程中我收获的不仅仅是知识、实验技能和经验,更有对科研工作的端正态度和实事求是的实验原则。感谢李振丽老师给予我的规范示教和指导,感谢分子生物实验室的师兄师姐的耐心指导和关心,今后在学习生活中,我将更加努力,克服困难,争取在未来的道路上做出造福于人的科研成果!
-
20xx 动物细胞培养技术实验报告
一实验目的1学习并掌握动物细胞培养的无菌操作技术2学习并掌握细胞传代培养的方法3学习并掌握用倒置荧光显微镜观察细胞细胞形态二实验原…
-
细胞培养实验报告
动物细胞培养一试验目的1掌握无菌操作技术2掌握原代和传代细胞培养3掌握细胞冷冻和复苏技术4了解培养成纤维细胞的形态二试验原理将动物…
-
动物细胞培养实验设计
动物细胞培养技术实验报告生物技术1004班第四组实验一仪器的清洗与灭菌及培养基的配制一实验目的能独立地进行用于细胞培养的各种器皿的…
-
原代细胞培养实验报告
实验细胞培养1实验目的初步掌握哺乳动物细胞的原代培养与传代培养的基本操作过程为生物工程在医学上的应用打下基础2实验原理从生物体中取…
-
L1120细胞培养实验报告终结版
L1120细胞培养L1120细胞培养一实验目的1了解培养室的设置和设备2学习无菌概念和无菌操作要领熟练各实验器材的使用3学习并掌握…
-
细胞生物学综合性实验报告
本科学生实验报告学号姓名学院生命科学学院专业班级11级生物科学C班实验课程名称细胞生物学实验指导教师及职称吴暇玉开课时间20xx至…
-
原代细胞培养实验报告
实验细胞培养1实验目的初步掌握哺乳动物细胞的原代培养与传代培养的基本操作过程为生物工程在医学上的应用打下基础2实验原理从生物体中取…
-
细胞生物学实验报告
染色体标本的制备及观察泮力菁20xx0014009120xx级生物基地同组者商倩倩实验目的1掌握染色体标本制作的方法2认识不同生物…
-
细胞生物学实验报告
细胞生物学实验报告细胞生物学实验报告小鼠脾细胞原代培养姓名杜旭学号20xx00230155系年级20xx级临七一班同组者赵伟日期2…
-
细胞生物学实验报告5
湖南科技学院实验报告学生姓名李诗学号20xx07004215专业生物技术年级班级1102课程名称细胞生物学实验实验指导老师蒋琼凤沈…
-
细胞工程实验报告
细胞工程实验报告专业生物技术班级0801姓名励丹学号30804305一实验目的1了解动物细胞培养的相关实验器材以及实验前器材的清洗…