实验一 燃烧热的测定
实验一 燃烧热的测定
(一)、实验目的
1.掌握氧弹式量热计使用方法及测量物质燃烧热的技术。
2.测定萘的摩尔燃烧热。
(二)、实验原理
燃烧热是指温度为T时由物质B与氧进行完全氧化时所放出的热。所谓完全氧化是指C全部生成CO2,H全部生成H2O(l),若有CO或游离C产生则说明氧化不完全甚至很不完全。
燃烧热可在恒容或恒压情况下测定。如在298.15K和101325Pa下,苯甲酸的恒压燃烧热(摩尔燃烧热)为3326.8kJ·mol-1。在实验中用氧弹量热计进行实验时,氧弹放置在装有一定量水的铜水桶中,水桶外是空气隔热层,再外面是温度恒定的水夹套。样品在体积固定的氧弹中燃烧放出的热、引火丝燃烧放出的热和由氧气中微量的氮气氧化成硝酸的生成热,大部分被水桶中的水吸收;另一部分则被氧弹、水桶、搅拌器及温度计等所吸收。在量热计与环境没有热交换的情况下,可写出如下的热量平衡式:
 (1-1)
(1-1)
式中: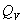 —被测物质的定容热值,单位为J·g-1;
—被测物质的定容热值,单位为J·g-1;
 —被测物质的质量,单位为g;
—被测物质的质量,单位为g;
q—引火丝的热值,单位为J·g-1(铁丝为-6694J·g-1);
b—烧掉的引火丝质量,单位为g;
5.98—硝酸生成热为-59831 J·mol-1,当用0.100mol·L-1NaOH滴定生成的硝酸时,每毫升碱相当于-5.98J;
c—滴定生成硝酸时耗用0.100mol·L-1NaOH的毫升数;
W—水桶中水的质量单位g;
h—水的比热容单位J·g-1·K-1;
 —氧弹、水桶等的总热容单位J·K-1;
—氧弹、水桶等的总热容单位J·K-1;
 —与环境无热交换时的真实温差。
—与环境无热交换时的真实温差。
如在实验时保持水桶中水量一定,把(1—1)式右端常数合并得到下式:
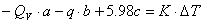 (1-2)
(1-2)
式中:( ),J·K-1;称为量热计常数。
),J·K-1;称为量热计常数。
若忽略空气中氮气氧化成硝酸时的生成热,故(1-2)式可写成:


则: 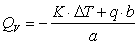
式中: 为量热计常数(14654 J·K-1);
为量热计常数(14654 J·K-1); 为引火丝(镍铬丝)发热值(1400 J·g-1)
为引火丝(镍铬丝)发热值(1400 J·g-1)
实际上,氧弹式量热计不是严格的绝热系统,加之由于传热速度到达最高温度需要一定的时间,在这段时间里系统与环境难免发生热量交换,因此燃烧前后温度变化的测量值必须经过雷诺作图法进行校正,其校正方法如下:
将燃烧前后每次观察到的温度对时间作图,取成a b c d 线[如图 1 (a) 图中b相当于开始燃烧之点,c为观察到最高的温度读数点,由于量热计和外界的热量交换,曲线ab及cd常常发生倾斜。取b点所对应的温度T1,c点所对应的温度T2,其平均温度(T1 + T2)/2为T,经过T点作横轴的平行线TO与曲线相交于O点,然后过O点作TO的垂直线AB,此线与ab、cd线的延长线交于E、F两点,则E点和F点所表示的温差即为欲求温度的升高值△T。图中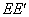 `表示环境辐射进来的热量而造成量热计温度的升高,这部分是必须扣除的,而
`表示环境辐射进来的热量而造成量热计温度的升高,这部分是必须扣除的,而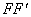 表示量热计向环境辐射出的热量而造成量热计温度的降低,因此这部分是必须加入的。
表示量热计向环境辐射出的热量而造成量热计温度的降低,因此这部分是必须加入的。
有时量热计的绝热情况良好,热量散失少,而搅拌器的功率又比较大,这样往往不断引进少量热量,使得燃烧后的温度最高点不会明显出现,这种情况下△T仍然可按照同法进行校正[如图1-3(b)]。

图1 (a) 绝热较差时系统温度校正图 图1 (b) 绝热良好时系统温度校正图
图1 雷诺校正图
从(1-2) 式可知,要测得样品的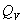 ,必须知道量热计的总热容
,必须知道量热计的总热容 。测定方法是以一定量的已知燃烧热的标准物质(本实验用苯甲酸),在相同条件下进行实验。用图解法对温差
。测定方法是以一定量的已知燃烧热的标准物质(本实验用苯甲酸),在相同条件下进行实验。用图解法对温差 进行校正后,就可按式(1-2)算出
进行校正后,就可按式(1-2)算出 来,求得
来,求得 后,就可求出被测物质的
后,就可求出被测物质的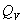 值来。本实验所测之样品为萘。
值来。本实验所测之样品为萘。
测定燃烧热可以在恒容条件下进行,也可以在恒压条件下进行。由热力学第一定律可知:恒容燃烧热(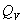 )等于内能的变化
)等于内能的变化 ,恒压燃烧热(
,恒压燃烧热( )等于焓变化
)等于焓变化 ,而化学反应的热效应(包括燃烧热)通常是用恒压热效应(
,而化学反应的热效应(包括燃烧热)通常是用恒压热效应( )来表示的。本实验是在氧弹内进行(氧弹结构如图1-2所示),由于氧弹的体积固定,所测定的热效应是恒容热效应
)来表示的。本实验是在氧弹内进行(氧弹结构如图1-2所示),由于氧弹的体积固定,所测定的热效应是恒容热效应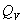 。而
。而 ,若忽略固体与液体在体系中所占体积,并假设气体遵守理想气体定律,则
,若忽略固体与液体在体系中所占体积,并假设气体遵守理想气体定律,则 ,因
,因 为常数,反应中温度可看作是固定的,则
为常数,反应中温度可看作是固定的,则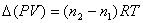 ,其中
,其中 、
、 分别为反应物与产物的气体摩尔数,所以有:
分别为反应物与产物的气体摩尔数,所以有:

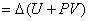

 (1-3)
(1-3)
(三)、仪器药品
HR-15A数显氧弹式量热计一套、压片机、电子分析天平、镊子、万用电表、高压氧气源、引火丝(镍铬)、扳手、2000毫升容量瓶、1000毫升容瓶、250毫升锥形瓶、50毫升碱式滴定管
0.1mol·L-1NaOH标准溶液、苯甲酸(A.R)、酚酞指示剂、萘(A.R)、棉纱
(四)、实验步骤
1.量热计总热容测定
(1)准备工作
a.将本次实验所需用的苯甲酸标准样品,用玛瑙研钵研细,然后放在烘箱中,于100℃烘干3-4小时,取出后放在干燥器中冷却并达到恒重,即烘干前后每克苯甲酸的重量变化不大于0.0005克为止。
b.用滤纸或纱布将压片机(特别是其横槽内壁及压试样芯棒)和氧弹内壁擦干净 (用镊子夹住纱布擦)。
c.将量热桶内、外壁、外套内壁,搅拌器等用纱布擦干净。
d.截取长约15厘米的一段引火丝放在电子天平上准确称量,并将引火丝缠绕成螺旋状备用。
(2)压片
为防止待测物质燃烧时向四处散裂,可将其在压片机上压为片状。首先在台秤上称取 0.4~0.5克样品,倒入压片—机横槽内,旋转把手至不能再转动为止。通常压出的试样表面粘有污物,此时可用刀片将污物轻轻刮去,然后在干净的玻璃板上敲击2—3次,再用小毛刷扫去附着于样品片上的小颗粒,最后在电子天平上准确称量。
(3)装氧弹
a.将擦干净的氧弹盖用手拧下放在专用架上,装好铁坩锅(燃烧器)。
b.将燃烧丝的两端固定在电极上(注意:使用金属燃烧器,电极不能与燃烧器任何部位接触,否则引起短路)。
c.将试样放入燃烧器,并且使试样与燃烧丝很好接触(45度斜靠于燃烧丝上),再用万用电表检查接上燃烧丝后的点火电路接触是否良好。
d.向氧弹中加入10毫升蒸馏水后将弹盖轻轻旋紧,以检查是否漏气。其方法是:将充氧后的氧弹放入水中(充氧方法见4),水的高度应在氧弹盖之上、进气阀中间为宜,如果漏气,此时应检查出漏气点并进行处理,直至不漏气为止。
(4)充氧气
氧弹不漏气后,可将氧弹外壁擦干,用放气冒压住进气嘴,放出弹内气体。将被测物装入坩锅后放在坩锅架上,将引火丝与电极连接好旋紧氧弹盖,慢慢提高氧气瓶的输出压力至2.0MPa~2.5MPa(20~25大气压),充气60秒(如果高压下氧气表漏气时,可先在1~1.5MPa压力(10~15大气压)下充氧20秒,再调到2.0MPa~2.5MPa压力下(20—25大气压)充气50秒,随后关闭气源,抬起充氧器压把。
(5)实验操作
a.按图1—1把仪器装好,先把各电源插头插上,打开控制器电源开关;然后向量热桶内注入2000毫升水,把氧弹放入量热桶中,然后把电极插入氧弹的电极孔中再倒入1000 毫升水;盖上量热计上盖插上测温探头。
b.水温的调节很关键,用塑料桶取自来水3500毫升左右,用测夹套水温的温度计测量水温,水温调节到比夹套的水温低0.5~0.8℃;水温的高低用热水和冰来调节。
c.开动搅拌器。待温度变化基本稳定后,开始记录点火前最初阶段的温度,每隔半分钟记一次(由温度控制器提示)。共10个时间间隔数据,即11个读数。在读第11个数据的同时,立即按点火按钮点火。如果指示灯亮后马上又熄灭,表示燃烧已点着火,此时温度上升较快。(若温度变化很小,表示没点着火,此时要检查原因),且仍以每半分钟继续读数至温度开始下降后,再读取最后阶段的10次数据,便可停止读数。
d.关闭总电源及各开关,将氧弹取出擦干,打开出气阀放出弹内废气,再打开弹盖看坩锅内样品是否燃烧完全。若还有药品及黑色碳粒,即为未完全燃烧,此次实验失败重作;若燃烧完全。则取下未燃完的燃烧丝后,在分析天平上称量未燃烧完的燃丝重量。
2.同上所述步骤,以萘为样品进行实验。
3.实验完毕后,倒去量热桶中的水,用纱布擦干所有设备,以备下次实验用。
(五)、实验记录与结果处理
1.实验记录
室温: 21℃ Pa(大气压): 101.65 日期: 3.20

2.结果处理:
(1)升温曲线及雷诺曲线近似处理


(2)求萘的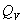 值:
值:
由图查得 294.108K
294.108K  293.23K
293.23K 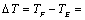 0.878K
0.878K
 = -(14654J/k*0.878K+1400J/g*0.009g)/0.3641g=-35371.63417J
= -(14654J/k*0.878K+1400J/g*0.009g)/0.3641g=-35371.63417J
 128g/mol*-35371.63417J=-4527569.174J
128g/mol*-35371.63417J=-4527569.174J
 -4527569.174+1mol*8.314J/(mol*k)*294K=-4525124.858J
-4527569.174+1mol*8.314J/(mol*k)*294K=-4525124.858J
 [-4525124.858-(-26580J/g*128g)]/(-26580J/g*128g)=33%
[-4525124.858-(-26580J/g*128g)]/(-26580J/g*128g)=33%
(六)、实验注意事项
1.氧弹内壁和氧气表上不能沾有油污,特别注意不能用手接触氧弹内壁,以免由油污引起爆炸危险。
2.在检查氧弹漏气和给氧弹充氧气这两步骤时,要注意不要使氧弹震动和倾斜,以防样品从坩锅中掉落。
3.接引火丝时,要特别注意电极与引火丝相接处要拧紧,使其接触良好,且不要使两电极接触,否则样品将不能燃烧。
(七)、思考题
1.在使用氧气钢瓶和氧气减压阀时,应注意那些问题?
答:氧气减压阀应严禁接触油脂,以免发生爆炸
减压阀应该避免撞击和振动,不可与腐蚀物质接触
2.萘燃烧的反应方程式,如何根据实验测得的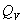 求出
求出 ?公式(1-3)中各项的物理化学意义是什么?
?公式(1-3)中各项的物理化学意义是什么?
C10H8(s)+12O2(g)=10CO2(g)+4H2O(l)
将被测物放入充有一定压力2.5MPa氧气的氧弹中,充分燃烧时放出的热使氧弹周围的介质温度升高,通过测定燃烧前后量热计温度的变化值,就可以测出样品的燃烧热。
Qv——被测物的恒容燃烧热 n——物质的量的变化 R——摩尔气体常量 T——温度中值。
3.实验测得的温差为什么要进行校正?还有哪些误差来源会影响实验结果?
答:因为氧弹量热计不可能完全绝热,热漏在所难免。因此,燃烧前后温度的变化不能直接用测到的燃烧前后的温度差来计算,必须经过合理的雷诺校正才能得到准确的温差变化。
另外,称量的误差、燃烧不完全导致的误差、测定过程中样品的脱落等均会影响测定的结果。
第二篇:实验一燃烧热的测定 思考题答案
实验一燃烧热的测定思考题
1、开机的顺序是什么?打开电源—热量计数据处理仪—计算机
2、苯甲酸的药片是如何制做的? 用台称粗称苯甲酸1克---倒入------压片机的模子内------缓旋紧压片机的螺杆----直到成片状----抽去模底托板-----再下压(使钢模底板和样品一起脱落)-------压模后除去样品表面的碎屑,用分析天平准确称量其重量。
3、萘的燃烧热测定是如何操作的? 1.试样,氧弹准备---氧弹充气-----测定(氧弹放入量热计桶,插上电极加水,再盖上盖---在电脑上输入相关内容按提示做)测定要10分钟燃烧样品萘时,内筒水是否要更换和重新调温?要
4、燃烧皿和氧弹每次使用后,应如何操作?洗净。擦干
5、氧弹准备部分,引火丝和电极需注意什么? 不接触……引火丝与试样要紧密接触但不能碰到燃烧皿(防点火失败短路)。电极也是不能碰到燃烧皿而且两电极不能靠近(以防短路)
6、测定量热计热容量与测定萘的条件可以不一致吗?为什么?可以,因为它们是各自独立的实验
7、量热计热容量的测定中,“氧弹充氧” 这步如何操作?将铜线管与氧弹头连接----反时针旋松氧气表的减压阀------打开钢瓶阀门----顺时针旋紧----缓通入氧气(压气增大到2。5Pka,不少于三十分钟)----关闭钢瓶阀门,减压阀--------装好氧弹头。检是否通路。
8、实验包含几部分内容?3 步 名称是什么?1、仪器的准备2、量热计热容量的测定3、每部分的实验药品是什么? 苯甲酸
9、药片是否需要干燥?需要 药片压药片的太松和太紧行不行? 不行。压得太紧,点火后难以燃烧;太松,容易脱落。
10、量热计热容量的测定中,“热容量测定”这步如何操作?氧弹放入量热计水友桶中-----插上电极-----加入2。6升水-----盖上盖
打开实验界面-----输入相关内容----储存----点击开始实验-----按提示完成实验
11、充氧的压力和时间为多少?2.5Mpa和1分钟 充氧后,将如何操作?关闭减压阀、卸导气管接头、拧好螺丝、检查电极是否通路(用万能表测其电阻小于20欧姆)、检漏
充氧压力为2.5Mpa 时间不少于30秒,差不多一分钟。充氧后,关闭钢瓶阀门,放掉氧气表中的余气,关闭减压阀。将充好氧气的氧弹再次用万用电表检查两电极是否(要求约3-8欧姆)通路,若通路,则可将氧弹放入量热计的盛水桶内检漏
12、说出公式 各项的意义?
各项的意义?
Qv------- 被测物的恒容燃烧热,J/g
a-------被测物的质量,g
80J------引火丝的燃烧热
0.0015--------氮气燃烧生成硝酸生成热的修正系数
K------称为量热计常数,J/K
t-------系统与环境无热交换的真实温差
13、搅拌时有摩擦声对实验结果有何影响?搅拌时有摩擦会使有热量生成,会影响温度的测定,
14、本实验中,那些为体系?那些为环境?盛水桶内部物质及空间为系统,除盛水桶内部物质及空间的量热计其余部分为环境。
15、实验中苯甲酸和萘的量取的一样多吗?不能取一样多,粗苯甲酸1克,粗萘0.7克
16、若待测样品受潮,对实验结果有何影响?会使试样燃烧不充分,从使实验测量有很大的误差
17、水桶中的水温为什么要选择比外筒水温低?为什么?①检验多功能控制器数显读数是否稳定。熟习压片和氧弹装样操作,量热计安装注意探头不得碰弯,温度与温差的切换功能键钮,报时及灯闪烁提示功能等。
②干燥恒重苯甲酸(0.9~1.2g)和萘(0.6~0.8g)压片,注意紧实度,分析天平称样。③容量瓶量取3000mL水,调节水温低于室温1K。
④量取两根10厘米点火丝,中段在原珠笔蕊上绕几圈。燃烧丝缚紧使接触电阻尽可能小。氧弹充氧注意小动作缓缓旋开减压阀。
⑤氧弹内预滴10mL水,促产物凝聚成硝酸。
低多少合适?1摄氏度
18、如何用萘的燃烧热资料来计算萘的标准生成热。
19、充氧量太少会出现什么情况?燃烧不充分造成实验误差大
20、压片时,压力必须适中,片粒压的太紧对实验结果有何影响?会难以燃烧
21、实验过程中有无热损耗,如何降低热损耗?
22、如何由萘的实验数据Qv,(
 )求萘的Qv,m(
)求萘的Qv,m(
 )?
)?
23、如何确保样品燃烧完全?样品压成片状,引火丝不能接触到燃烧皿,其线圈与样品间不能大于5mm
24、压片时,压力必须适中,片粒压的太松对实验结果有何影响?太松则会使样品易脱落
25、搅拌太慢或太快对实验结果有何影响?搅拌太快则会易于和壁碰撞,损坏,热量的散失的快,温度降得快,不易控制好,若是太慢则是使水中的热量渐损失到空气中,都是造成误差,会影响了实验。
26、写出萘燃烧过程的反应方程式?
萘的燃烧方程:C10H8(s)+12O2(g)=10CO2(g)+4H2O(l),
苯甲酸C7H6O2(s)+7.5O2 = 7CO2(g)+3H2O(l)
27、如何根据实验测得的Qv 求出Qpm?写出公式?将被测物放入充有一定压力2。5Mpa氧气的氧弹中,充分燃烧时放出的热量使用权氧弹及周围的介质介质升高。通过测定燃烧前后量热计温度的变化值,就可以得出该样品的燃烧热。
-
燃烧热的测定实验报告
实验二燃烧热的测定一、目的要求1.用氧弹量热计测定萘的燃烧热。2.了解氧弹量热计的原理、构造及使用方法。二、实验原理1摩尔物质完全…
-
物化实验报告燃烧热的测定
华南师范大学实验报告一实验目的1明确燃烧热的定义了解定压燃烧热与定容燃烧热的差别2掌握量热技术的基本原理学会测定萘的燃烧热3了解氧…
-
燃烧热的测定实验报告 20xx.11.9
华南师范大学实验报告一、实验目的1.明确燃烧热的定义,了解恒压燃烧热和恒容燃烧热的差别和联系;2.掌握量热技术的基本原理,学会测定…
-
一、燃烧焓的测定实验报告
物理化学实验报告实验名称学院专业班级姓名指导教师日期燃烧焓的测定学号一实验目的1用氧弹式量热计测定萘的燃烧焓2明确燃烧焓的定义了解…
-
燃烧热的测定 实验报告
燃烧热的测定一、实验目的●使用氧弹式量热计测定固体有机物质(萘)的恒容燃烧热,并由此求算其摩尔燃烧热。●了解氧弹式量热计的结构及各…
-
大学物理化学实验报告-燃烧热的测定
物理化学实验报告院系化学化工学院班级化学061学号13姓名实验名称燃烧热的测定日期20##.5.20同组者姓名室温气压成绩一、目的…
-
物化实验报告燃烧热的测定
华南师范大学实验报告学生姓名学号专业化学师范年级班级课程名称物理化学实验实验项目燃烧热的测定实验类型验证设计综合实验时间20xx年…
-
物化实验报告燃烧热的测定
华南师范大学实验报告一实验目的1明确燃烧热的定义了解定压燃烧热与定容燃烧热的差别2掌握量热技术的基本原理学会测定萘的燃烧热3了解氧…
-
华师物化实验报告 燃烧热的测定
华南师范大学实验报告学生姓名学号专业年级班级课程名称实验项目燃烧热的测定实验类型验证设计综合实验时间年月日实验指导老师实验评分一实…
-
燃烧热的测定实验报告
浙江万里学院生物与环境学院化学工程实验技术实验报告实验名称燃烧热的测定1一实验预习30分1实验装置预习10分年月日指导教师签字成绩…