BZ振荡反应
实验十二 BZ振荡反应
一、实验目的
1.了解BZ振荡反应的基本原理;体会自催化过程是产生振荡反应的必要条件。
2.初步理解耗散结构系统远离平衡的非线性动力学机制。
3.掌握测定反应系统中电势变化的方法;了解溶液配制要求及反应物投放顺序。
二、实验原理
目前研究的较多、较清楚的典型耗散结构系统为BZ振荡反应系统,即有机物在酸性介质中被催化溴氧化的一类反应,如丙二酸在Ce4+的催化作用下,自酸性介质中溴氧化的反应。
- 2BrO3+3CH2(COOH)2+2H+?2BrCH(COOH)2+3CO2+4H2O (1) 真实反应过程是比较复杂的,该反应系统中HBrO2中间物是至关重要的,它导致反应系统自催化过程发生,从而引起反应振荡。为简洁的解释反应中有关现象,对反应过程适当简化如下:
当Br浓度不高时,产生的HBrO2中间物能自催化下列过程:
- BrO3+HBrO2+H+?2BrO2+H2O (2) -
BrO2+Ce3++H+?HBrO2+Ce4 + (3) 在反应(3)中快速积累的Ce4+又加速了下列氧化反应: 4+- 4Ce+BrCH(COOH)+HO?+HOBr223++ ( O+6H2Br+4Ce+43)C2通过反应(4),当达到临界浓度值CBr-,c后,反应系统中下列反应成为主导反应:
- BrO3+Br-+2H+?HBrO2+HOBr (5)
HBrO2+Br-+H+?2HOBr (6)
反应(6)与反应(2)对HBrO2竞争,使得反应(2)、(3)几乎不发生。Br不断消耗,当Br消耗到临界值以下,则反应(2)、(3)为主导作用,而反应(5)、
(6)几乎不发生。由此可见,反应系统中Br浓度的变化相当于一个“启动”开关,当CBr-?CBr-,c时,反应(2)、(3)起主导作用,通过反应(4)不断使Br
----积累;当CBr-?CBr-,c时,反应(5)、(6)起主导作用,Br又被消耗。由于反-
应(2)、(3)中存在自催化过程,使动力学方程式中出现非线性关系,导致反应系统出现振荡现象。Br在(5)、(6)中消耗,又在反应(4)中产生;Ce3+、Ce4+-
分别在(3)、(4)中消耗和产生,所以Br、Ce3+、Ce4+在反应过程中浓度会出-
-现周期性变化,而BrO3和CH2(COOH)2反应物,在反应过程中不断消耗,不
会再生,因此,它们不会出现振荡现象。
、(6)可求得 CBr-,c值又反应(2)
k6CHBrOCBr-,cCH+?k2CBrO-CHBrOCH+ 223
?6所以 CBr-,c?k2CBrO-/k6?5?10CBrO- 33
三、仪器与试剂:
NDM-1电压测量仪; SYC-15B超级恒温水浴;
磁力搅拌器; 反应器100ml;
217型甘汞电极; 213型铂电极;
数据采集接口装置; 计算机;
溴酸钾(GR); 硝酸铈铵(AR);
丙二酸(AR); 浓硫酸(AR)。
四、实验步骤:
1.用1.00mol?dm?3硫酸作217型甘汞电极液接;
2.按图连接好仪器,打开超级恒温水浴,将温度调节至25.0±0.1℃; 3.配制0.45mol?dm?3丙二酸250ml、0.25mol?dm?3溴化钾250ml、3.00
mol?dm?3硫酸250ml;在0.20mol?dm?3硫酸介质中配制4?10?3mol?dm?3的
硫酸铈铵250ml。
4.在反应器中加入已配好的丙二酸溶液、溴酸钾溶液、硫酸溶液各15ml; 5.打开磁力搅拌器,调节合适速度;
6.将精密数字电压测量仪置于分辨率为0.1mV档(即电压测量仪的2V档),7.恒温5min后,加入硫酸铈铵溶液15ml,观察溶液颜色的变化,同时开始计时并记录相应的变化电势;
8.电势变化首次到最低时,记下时间t诱;
9.用上述方法将温度设置为30℃、35℃、40℃、45℃、50℃重复实验,并记下t诱; 10.根据t诱与温度数据ln(1/t诱)?1/T作图。
五、数据记录与处理
实验数据如表一。
表一 实验数据表
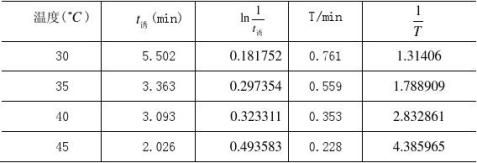
(10).根据表一可以得到ln(1/t诱)?1/T的关系图。 如图1.
图1 不同温度下的ln(1/t诱)?1/T的关系图
依据上图就可求出任何温度下的诱导期和振荡周期。
六、思考题
1.试述影响诱导期的主要因素。
答:中间体的生成速率。
2.初步说明BZ振荡反应的特征及本质。
答:BZ振荡反应的特征如下:(1)反应必须是敞开系统,且远离平衡态;(2)反应历程中应包含自催化的步骤;(3)系统具有双稳定性。
BZ振荡反应的本质是必然是耗散结构,化学振荡的动力学具有非线形的微分速率公式。
3.说明实验中测得的电势的含义。
答:说明离子的浓度随时间的周期性变化情况从而导致电势周期性的发生变化。
第二篇:化学振荡-BZ振荡反应二 校
化学振荡——BZ振荡反应
一、背景材料
在化学反应中,反应产物本身可作为反应催化剂的化学反应称为催化反应。一般的化学反应最终都能达到平衡状态(组分浓度不随时间而改变),而在自催化反应中,有一类是发生在远离平衡态的体系中,在反应过程中的一些参数(如压力、温度、热效应等)或某些组分的浓度会随时间或空间位置作周期的变化,人们称之为“化学振荡”。由于化学振荡反应的特点,如体系中某组分浓度的规律变化在适当条件下能显示出来时,可形成色彩丰富的时空有序现象(如空间结构、振荡、化学波……等)。这种在开放体系中出现的有序耗散结构也证明负熵流的存在,因为在开放体系中,只有足够的负熵流才能使体系维持有序的结构。化学振荡属于时间上的有序耗散结构。
别洛索夫(Belousov)在1958年首先报道以金属锌离子作催化剂在柠檬酸介质中被溴酸盐氧化时某中间产物浓度随时间周期性变化的化学振荡现象,扎勃丁斯基(Zhabotinski)进一步深入研究在1964年证明化学振荡体系还能呈现空间有序周期性变化现象。为纪念他们最早期的研究成果,,将后来发现大量的可呈现化学振荡的含溴酸盐的反应体系为B-Z振荡反应。
随着研究的深入,人们发现所有的振荡反应都含有自催化反馈步骤,同时也发现了许多能发生振荡反应的体系(振荡器Dscillator)尽管如此,但化学振荡的动力学机理,特别是产生时一些有序现象的机理仍步完全清楚。对于B-Z振荡反应,人们比较认可的FKN机理,是由Field、Koros、Noyes等完成的。近年来研究表明还存在着其他类型的振荡(如连续振荡、双周期振荡、多周期振荡等)化学振荡直观地展现了自然科学中普遍存在的非平衡非线性问题,故自发现以来一直得到人们的重视。目前,随着对化学振荡研究的深入,许多化学振荡器陆续被设计出来,与此同时,对化学振荡的应用研究也已经开始。本实验仅对含溴酸盐体系的B-Z振荡反应进行设计性的探讨。
先通过典型的例子来了解B-Z振荡反应的原理。
将含有溴酸钾、丙二酸的溶液与溶于硫酸的硝酸铈(铵)溶液混合,用仪器可以记录到反应中溴离子浓度 和铈离子浓度比
和铈离子浓度比 随时间作周期性的变化曲线。由于
随时间作周期性的变化曲线。由于 呈黄色而
呈黄色而 无色,反应中还可以观察到体系在黄色和无色之间作周期性的振荡。
无色,反应中还可以观察到体系在黄色和无色之间作周期性的振荡。
FKN机理认为丙二酸在硫酸介质中及金属铈离子的催化作用下被溴酸氧化。在过量丙二酸存在时,净反应过程为:


根据FKN机理,B-Z振荡不少于11个元反应,若抓住其中三个关键物质, 、
、 、
、 ,则可以简化为用6个元反应来描述:
,则可以简化为用6个元反应来描述:
过程A:当 足够大时
足够大时
(1)  (慢)
(慢)
(2)  (快)
(快)
(注:此处 一旦生成,立即与丙二酸反应,被消耗)。
一旦生成,立即与丙二酸反应,被消耗)。
过程B:当 较小时,
较小时, 按下式被氧化。
按下式被氧化。
(3) (慢)
(慢)
(4)  (快)
(快)
(5)
过程C:溴离子 再生
再生
(6)
过程A、B、C合起来组成反应系统中一个振荡周期。
从过程B看出,当 较小时,
较小时, 的生成具有自催的特点。当
的生成具有自催的特点。当 足够大时,
足够大时, 按反应(2)消耗,随着
按反应(2)消耗,随着 的降低,反应(3)同时对
的降低,反应(3)同时对 的竞争,当
的竞争,当 达到某临界值
达到某临界值 临界时,过程B中自催化引起
临界时,过程B中自催化引起 的生成速率正好等于过程A中
的生成速率正好等于过程A中 的消耗速率。
的消耗速率。
若体系中 <
< ,
, 通过自催化迅速增加,而导致[
通过自催化迅速增加,而导致[ ]通过反应(2)迅速下降,系统的主要过程从A过程切换到B过程,最后通过C过程使
]通过反应(2)迅速下降,系统的主要过程从A过程切换到B过程,最后通过C过程使 再生。若体系中
再生。若体系中 >
> ,体系中
,体系中 的自催化生成受到抑制,系统又从B过程切换到A过程,从而完成一个循环。
的自催化生成受到抑制,系统又从B过程切换到A过程,从而完成一个循环。
可见当 足够大时,反应按A过程进行;随着
足够大时,反应按A过程进行;随着 下降,反应从A切换到B过程,通过C过程使
下降,反应从A切换到B过程,通过C过程使 再生,因此,
再生,因此, 在振荡反应中相当于“选择开关”作用。而铈离子在反应中起催化作用,催化B过程和C过程。
在振荡反应中相当于“选择开关”作用。而铈离子在反应中起催化作用,催化B过程和C过程。
通过B-Z振荡曲线,可以了解研究其反应,由于反应中 和
和 随时间作周期性变化,在实验中,用溴离子选择电极、铂电极分别测定
随时间作周期性变化,在实验中,用溴离子选择电极、铂电极分别测定  和
和 随时间的变化曲线。这些振荡曲线,可用四个参数描述,图35-1为B-Z反应中
随时间的变化曲线。这些振荡曲线,可用四个参数描述,图35-1为B-Z反应中 随时间变化曲线。
随时间变化曲线。 
图35-1 B-Z振荡曲线
通过振荡曲线,得到以下振荡参数:
振荡诱导期 tin :从反应开始到出现振荡的时间。
振荡周期 tp :完成一次振荡循环所需的时间。
振荡寿命tl :从开始振荡到体系振荡结束所需的时间。
振幅ΔE::每次振荡循环的最高点与最低点的电势差。
通过振荡不同曲线提供的信息,可以深入了解振荡反应及影响反应的各类因素,如:
(1)温度对B-Z振荡反应的影响及反应活化能
升高温度可缩短tin、tp及tl,即可加速体系的振荡反应。可以通过测定不同温度下的tin和tp来估算表观活化能。
在实验中,如果用1/tin和1/tp来衡量在诱导期和振荡期间内反应速率的快慢,高诱导期速率常数 ,振荡速率常数
,振荡速率常数 ,根据阿仑乌斯公式:
,根据阿仑乌斯公式: ,得:
,得: ,可以通过不同温度下,对tin和tp的测定来求在反应诱导期的表观活化能
,可以通过不同温度下,对tin和tp的测定来求在反应诱导期的表观活化能 和反应振荡的表观活化能
和反应振荡的表观活化能
(2)反应物浓度的影响:
反应物浓度对振荡反应的影响主要表现在对tin、tp及tl的影响上。采用固定反应温度和其他反应物浓度,只改变一种反应物浓度,测定tin、tp及tl随反应物浓度的变化关系,以其对数作图,在一定浓度范围内可得直线,根据直线的斜率,可求得振荡反应各参数与各反应物浓度之间的定量关系[5 ]。
如对木糖-BZ体系中,(XY代表木糖,Act代表丙酮)测得:



在B-Z体系振荡终止后,加入少量某一种反应物,体系可重新发生振荡反应,而加入其他各级反应物均不能使体系重新振荡,说明体系的振荡寿命由该反应物来决定,当它的浓度低于振荡反应的临界浓度,振荡反应终止,而增加其浓度,可使反应寿命延长;增加其他各反应物的浓度反而加速它的消耗,使振荡寿命缩短。
如下图35—3中为柠檬酸 ——— ———
——— ——
—— 体系中,振荡结束后,重新加入
体系中,振荡结束后,重新加入 ,又起振的曲线。
,又起振的曲线。

图35—2 B — Z振荡曲线
(3)其它因素的影响
① 的影响 :一般认为对B — Z反应,
的影响 :一般认为对B — Z反应,  具有抑制作用,它是通过竞争
具有抑制作用,它是通过竞争 来抑制振荡反应,当
来抑制振荡反应,当 达到一定浓度时,可使振荡中止。人们常在反应开始或反应中用易和
达到一定浓度时,可使振荡中止。人们常在反应开始或反应中用易和 反应的卤素离子来讨论它们的影响。
反应的卤素离子来讨论它们的影响。
②自由基的影响 :丙烯腈可作为常用的自由基抑制剂,在开始或在振荡过程中加入丙烯腈均能抑制振荡,这也说明了自由基参与了振荡反应。
③酸度的影响 :B —Z反应必须在酸性介质中进行,其中研究最多的是以 为介质的反应,增加酸度一般可缩短tin 及tp ,加快振荡反应。有时可用非氧化性的酸 ,如
为介质的反应,增加酸度一般可缩短tin 及tp ,加快振荡反应。有时可用非氧化性的酸 ,如 代替
代替 。对某些B — Z反应体系,酸度的变化会影响到反应机理以致产生一系列复杂的振荡现象。
。对某些B — Z反应体系,酸度的变化会影响到反应机理以致产生一系列复杂的振荡现象。
化学振荡的应用前景
近20年来,化学振荡已成为化学动力学的一个重要分支,人们从设计新型的化学振荡器到对性质、反应机理研究,从实验设计到对数学模型求解等方面都进行研究。同时也越来越注重应用方面 :如若对反应实行强制性振荡,可实现反应同期操作,提高反应产率及选择性 ;利用振荡的特征波进行化学分析(糖尿病的早期检测等);模拟生物体内的代谢循环反应……等等。所以学会探讨它的系列之一——B-Z反应是很有意义的。
二、实验要求:
1、查阅有关B-Z振荡反应资料1~3篇。
2、选定B-Z振荡的化学反应体系(化学振荡器)。
有人从耗散结构理论或从数理角度提出设计化学振荡器的方法和条件,但比较能具体指导实践的设计还是运用类比的方法[ 3 ]。根据B—Z反应的特点:①是氧化还原反应,②在酸性介质中,溴酸盐的还原生成电极电位很相近的不同价态中间产物 与
与 ,③
,③ 可发生岐化反应,其产物仍可继续循环反应。根据以上特点,可以从二方面来寻找:
可发生岐化反应,其产物仍可继续循环反应。根据以上特点,可以从二方面来寻找:
(1)不改变溴酸盐而根据氧化还原条件改变其对应的还原剂与金属催化剂及介质酸,即所有级分,除 外都可以改变。
外都可以改变。
(2)从元素电势图寻求类似于溴酸盐的其他元素(如Cl、I、Mn、S、N、As等)的不稳定价态的含氧盐及单质氧,在相应酸(或碱)条件下,以上述含氧盐及单质氧为氧化剂(或还原剂),再寻找对应的还原剂(或氧化剂)。
第一方面是以溴酸盐为氧化剂的体系,第二方面是以其他含氧酸盐为氧化剂的体系。本实验只以第一方面的范围来作设计尝试。
依照以上想法可断定,金属元素(或其某种络离子)的电对还原电极电位在1.51-1.00v之间的均可做为溴酸盐体系的催化剂,故有人总结出,几乎所有过渡金属(离子或络离子)都可用做振荡反应的催化剂(对于易氧化的配体,配体本身就可作为还原剂,形成仅有络离子和 的简单振荡器)。
的简单振荡器)。
另一方面,还可断定:当还原剂的电极电位在1.0v以下,这样一些具有活泼亚甲基氢的多氧有机化合物可划入还原剂的范围。如柠檬酸、丙二酸、苹果酸、酒石酸、乙酰丙酮、乙酰乙酸乙酯等脂肪族多元羧酸和多元酮及酯等。还可以尝试用无机还原剂或上述有机还原剂的同系物或衍生物等。
3、结合选定的反应体系,确定振荡参数测量方法(电化学方法或分光光度法等)。
4、寻找影响上述参数的因素,尝试进行定性或定量的分析讨论。如何讨论温度对反应影响及反应活化能;讨论化学振荡的调控(如何能再现、加快、抑制振荡)包括反应物浓度或用量比对反应的影响;讨论其他因素影响等等。
5、按论文形式,写实验报告一份。
三、参考方案
1. 装置
对丙二酸-溴酸钾-硝酸铈铵-硫酸的B-Z反应体系,可采用以下装置来测定其振荡曲线。


(图35--3实验装置图)
2. 操作注意事项
①各组分混合顺序对体系振荡行为有影响,建议先将丙二酸、溴酸钾、硫酸溶液置于反应烧杯中,开始搅拌器及记录仪,待基线稳定后,才加硝酸铈铵溶液。
②测表观活化能时,温度间隔取2摄氏度。
③平衡记录仪是记录实验结果振荡曲线的,此处若采用溴离子选择电极和离子活度计测量电势(E)随时间(t)的变化,也能反映 的变化,最好事先用标准
的变化,最好事先用标准 溶液校正电极对
溶液校正电极对 的响应关系。
的响应关系。
3.B-Z振荡反应体系介绍:
(1)丙二酸-溴酸钾-硝酸铈铵-硫酸体系
20ml 1.000mol/dm3丙二酸
15ml 0.200mol/dm3溴酸钾
15ml 2.4mol/dm3硫酸
2ml 0.0400 mol/dm3(NH4)2Ce(NO3)6
体系将在黄色和无色之间振荡。
可用饱和甘汞电极、铂电极和平衡记录仪记录电位变化的曲线和振荡参数。该体系中的丙二酸也可用柠檬酸等代替。
(2)在上述体系中加入邻菲罗啉铁指示剂(由0.7g硫酸亚铁、0.5g邻菲罗啉、100ml去离子水配成)7~10滴,体系颜色将在蓝色-红色之间振荡。因为铁离子和铈离子一样能起催化作用,使 [Fe3+] / [Fe2+] 随时间作周期性变化(Fe3+与邻菲罗啉形成蓝色络合物;Fe2+与邻菲罗啉形成红色络合物)。若将反应置于比色皿中进行,用分光光度剂在500nm的波长下,用秒表记录指针偏转一周所需的时间振荡周期,求连续稳定的6组数据,求平均振荡周期[ 1 ] 。
(3)葡萄糖(或木糖)-KBrO3-丙酮-MnSO4-H2SO4体系[ 5 ][ 6 ]
(4)丙二酸-碘酸钠-过氧化氢[ 4](少量淀粉作指示剂)。
附:
四. 参考文献
[1] 清华大学化学系物理化学实验编写组《物理化学实验》 清华大学出版社 1991.5
[2] 董小梅等《B-Z振荡反应》 化学教育
[3] 贺占博《化学振荡的研究方法》 化学通报 1992.2
[4] 许海涵《化学振荡》 化学通报 1984.1
[5] 李和兴等《木糖-BZ体系化学振荡反应的研究》 上海师范大学学报(自然科学版)1996.9
[6] 李和兴等《葡萄糖—BrO3—-Mn2+-H2SO4-丙酮体系的振荡反应》 物理化学学报1990.10
[7] 徐元昌等《化学振荡反应用于检测糖尿病》 化学世界 1992.3
[8] 赵学庄等《维生素C对B-Z反应的影响》 科学通报 1985
[9] 李和兴《葡萄糖B-Z体系中酸度变化诱导的复杂振荡反应》 无机化学学报 1991.Vol 7.No 4 1991.112
-
BZ振荡反应实验报告
验九BZ振荡反应一实验目的1了解BZ振荡反应的基本原理体会自催化过程是产生振荡反应的必要条件2初步理解耗散结构系统远离平衡的非线性…
-
实验八 BZ振荡反应实验报告
实验八BZ振荡反应一实验目的1了解BZ振荡反应的基本原理体会自催化过程是产生振荡反应的必要条件2初步理解耗散结构系统远离平衡的非线…
-
BZ振荡反应实验报告
B-Z振荡反应实验日期20##/10/18,提交报告日期20##/10/24指导教师:1引言实验目的了解Belousov-Zhab…
-
物理化学实验报告 BZ振荡反应
物理化学实验报告BZ振荡反应1实验报告1了解BZ反应的基本原理2观察化学振荡现象3练习用微机处理实验数据和作图2实验原理化学振荡反…
-
BZ振荡反应实验报告
BZ振荡反应孟醒09311202班1120xx239520xx年4月17日周四下午物理化学实验第八组一实验目的1了解BZ反应的基本…
-
安乐中心校岗位设置工作总结
按照县局岗位设置第三阶段工作安排,我校认真学习文件,在前期两个阶段工作基础上,第三阶段竞聘工作进展顺利,目前所有工作顺利结束,现将…
-
出差培训总结
江苏华鹏变压器厂培训总结在20xx年x月x日至20xx年x月x日我有幸去到江苏华鹏变压器厂进行7天的培训学习,在这几天里使我对变压…
-
八年级上册生物教学工作总结
20xx-20xx年秋季学期八年级生物教学工作总结龙山县湾塘中学包丽君本学期,我担任八年级61,62班的生物教学工作,从各方面严格…
-
事业单位岗位设置总结
乐至工业集中发展区管理委员会办公室事业单位岗位设置管理工作总结根据《资阳市人力资源和社会保障局关于报送事业单位岗位设置管理工作总结…
-
工作总结
新的一年新的开始,不知不觉20xx年的工作已告一段落。对于每一个追求进步的人来说,免不了会在年终岁未对自己进行一番“盘点”,说它是…