医疗器械临床试验报告
医疗器械临床试验报告
产品名称:
型号规格:
实施者:
联系人及联系电话:
承担临床试验的医疗机构名称:
临床试验单位的通讯地址(含邮编):
临床试验类别:
临床试验时间:
报告日期:
原始资料保存地点:
临床试验负责人(打印及签字):
年 月 日
说明
1、负责临床试验的医疗机构应本着认真负责的态度,公正、客观地按照临床试验方案进行临床试验,并填写本报告。
2、本报告必须由临床试验机构中有经验的主治医师以上的临床试验负责人签字。
3、临床试验类别分为临床试用和临床验证。

第二篇:医疗器械临床试验病例报告表
编 号:□□□□
患者姓名拼音缩写:□□□□
产品名称*****(商品名:***)
的安全性和有效性研究
病 例 报 告 表
(Case Report Form,CRF)
患者姓名拼音缩写:□□□□
试验编号:□□□□
医院名称:
研 究 者 签 名:
申办单位:上海******有限公司
病例报告表填写要求
1、所有记入本手册的数据需对照原始资料进行核查
2、用签字笔填写,中文字应清晰可辨,英文字母需大写
3、每格填写一个字,不适用的空格,请填“/”
4、选择项请打“√”
5、填写错误修改时,用单线划掉,切毋涂抹,原字迹需清晰可辨,并签名和注明修改时间
6、患者的姓名不得出现在本病例报告表中,患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字二字母,四字姓名填写每一个字的首子母。举例:张红ZHHO,张红旗 ZHQI 欧阳予黄 OYYH。
7、日期填写为:□□□□年□□月□□日。

一、入选标准:
1、年龄18~65岁,性别不限; □是 □否
2、创面面积小于体表面积的50%; □是 □否
3、签署知情同意书; □是 □否
如以上任何答案为“否”,则该病人不能入选
二、排除标准:
1、年龄小于18岁或大于65岁; □是 □否
2、有严重心、脑、肝、肾功能不全的患者; □是 □否
3、严重营养不良的患者; □是 □否
4、创面面积大于体表面积50%的患者; □是 □否
5、有精神疾病的患者以及无自知力、不能确切表达者。 □是 □否
如以上任何答案为“是”,则该病人不能入选
观察医师签名: 日期 年 月 日

受试者一般资料
姓名:□□□□ 性别: 男□ 女 □ 年龄:□□岁
出生日期:□□□□年□□月□□日
体重:□□□㎏ 病例号: □□□□□□
创面资料:
创面原因: □火焰 □热液 □化学 □电烧伤 □其他
创面形成时间:□□月□□日 创面部位:
创面面积:□□□□cm2 肉芽:无 □ 有 □
观察医师签名: 日期 年 月 日

用药后两组病例观察:

填表说明:
1、试验组的创面三周内愈合者,观察至创面愈合日;试验组的创面愈合期大于三周,观察至第三周。
2、肉芽组织色鲜红、较湿润,触之易出血为生长良好,记为A,如无肉芽生长记为C,两者之间为B。
3、愈合面积应填入已愈合面积占创面的百分比。
*有不良事件请填写“不良事件表”
两组创面疗效比较表

填表说明:
观察2组病例的创面肉芽生长情况,创面愈合程度,用药三周内创面愈合或缩小2/3以上且肉芽生长情况良好为显效;用药三周内创面缩小1/3以上为有效;用药三周创面缩小不到1/3为可疑有效;创面延迟愈合或无明显变化记为无效。
观察医师签名: 日期 年 月 日

实验室检查:
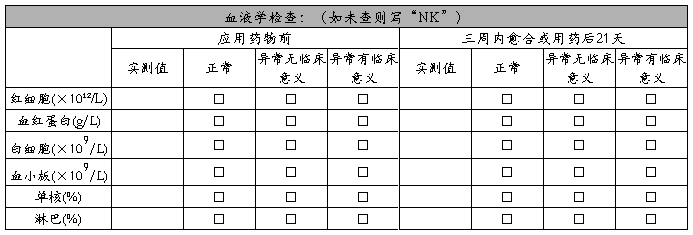

创面细菌培养(必要时):
创面重要细菌: 创面其它细菌:
创面是否照相记录:□是 □否
第一次照相:□□□□年□□月□□日;第二次照相:□□□□年□□月□□日
观察医师签名: 日期 年 月 日

患者是否完成全程研究: □是 □否
患者完成或退出研究日期:□□□□年□□月□□日
中止研究的原因: (限选一项)
□不良事件(填写非严重或严重不良事件报告表)
□缺乏疗效
□依从性差
□创面严重感染
□失访 详述
□患者要求 详述
□被申办者中止 详述
□其他原因 详述
观察医师签名: 日期 年 月 日

合并用药记录
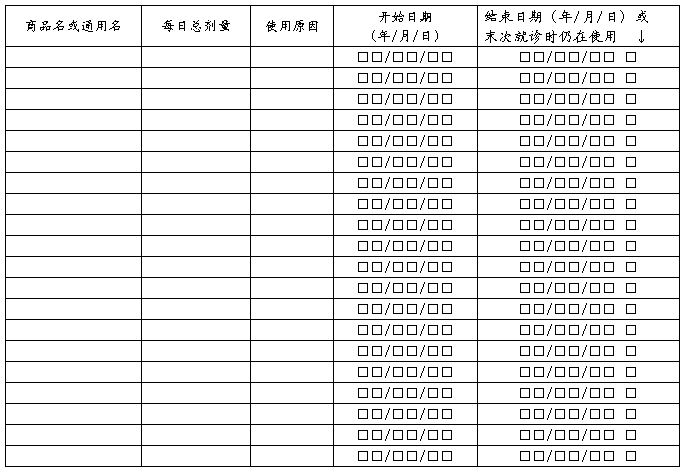
观察医师签名: 日期 年 月 日

不良事件
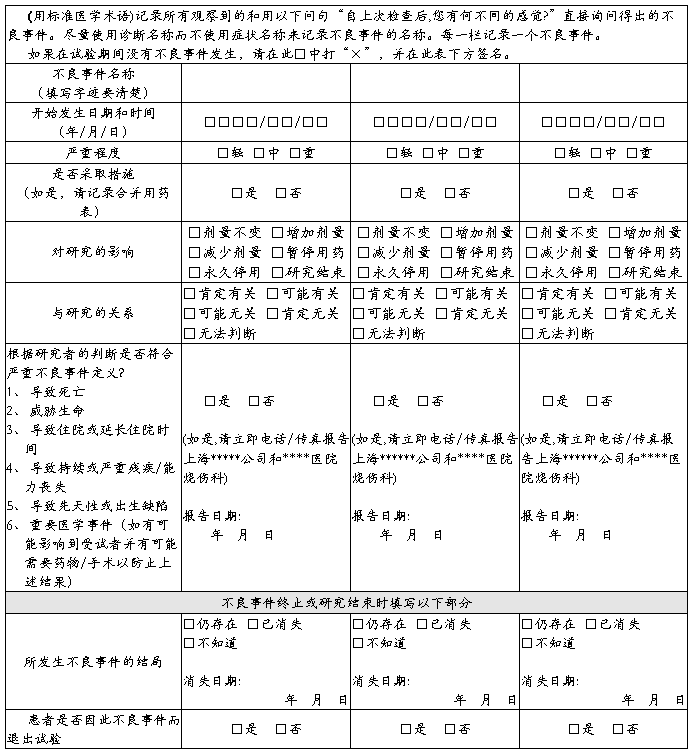
观察医师签名: 日期 年 月 日

CRF审核声明

监查员 年 月 日
-
医疗器械临床试验报告
医疗器械临床试验报告试验用医疗器械名称型号规格临床试验较高风险医疗器械目录是否中国境内同类产品有无临床试验机构临床试验开始时间临床…
-
医疗器械临床试验方案及报告
医疗器械临床试验方案产品名称型号规格实施者联系人及联系电话承担临床试验的医疗机构名称公章临床试验单位的通讯地址含邮编临床试验管理部…
-
医疗器械临床试验报告
纳米银祛痘凝胶临床试验报告医疗器械临床试验报告产品名称纳米银祛痘凝胶型号规格15g支每克凝胶含活性银600g实施者长春吉大高科技股…
-
医疗器械临床试验报告模板
医疗器械临床试验报告产品名称型号规格实施者承担临床试验的医疗机构临床试验类别临床试验负责人签字年月日说明1负责临床试验的医疗机构应…
-
医疗器械临床试验方案范本
XXXXXXXXXX医疗器械临床试验方案试验器械XXXXXXXXXXXXXXX试验目的XXXXXXXXXXXXXXX临床疗效及安全…
-
医疗器械临床试验中的统计学问题
《医疗器械临床试验规定》第十四条要求,医疗器械临床试验方案应当针对具体受试产品的特性,确定临床试验例数、持续时间和临床评价标准,使…
-
医疗器械临床试验方案及报告
医疗器械临床试验方案产品名称型号规格实施者联系人及联系电话承担临床试验的医疗机构名称公章临床试验单位的通讯地址含邮编临床试验管理部…
-
医疗器械临床试验报告
纳米银抗真菌喷雾临床试验报告医疗器械临床试验报告产品名称纳米银抗真菌喷雾型号规格30ml支含银600gml实施者长春吉大高科技股份…
-
医疗器械临床试验方案范本
XXXXXXXXXX医疗器械临床试验方案试验器械XXXXXXXXXXXXXXX试验目的XXXXXXXXXXXXXXX临床疗效及安全…
-
医疗器械临床试验病例报告表
编号:□□□□患者姓名拼音缩写:□□□□产品名称*****(商品名:***)的安全性和有效性研究病例报告表(CaseReportF…