咖啡因的提取,复方对乙酰氨基酚片 的制备及质量分析
药学专业综合实验
题目:咖啡因的提取,复方对乙酰氨基酚片
的制备及质量分析
学院: 医药学院
班级: xxxxxxxxxxx
姓名: xxxxxxxxxxxx
学号: xxxxxxxxx
一、复方对乙酰氨基酚的概述
复方对乙酰氨基酚主要成分是咖啡因、阿司匹林、对乙酰氨基酚。 是解热镇痛及非甾体抗炎类药品,其中对乙酰氨基酚通过抑制中枢神经系统的前列腺素的合成产生镇痛作用,咖啡因能增强镇痛效果,阿司匹林则通过下视丘体温调节中枢而起解热作用。
适用于头痛、牙痛、月经痛、神经痛、肌肉痛、风湿痛及发热。一般在常用剂量下耐受,在极个别情况下可引起恶心、呕吐、出汗、腹痛、皮肤苍白等。少数可发生皮肤过敏症(红疹、荨麻疹),粒细胞缺乏、血小板减少、肝功能损害等不良反应。
严重肝肾功能不全、溶血性贫血、学龄前儿童及对本品某一成份过敏者禁用。
二、茶叶中咖啡因的提取
(一)实验原理
咖啡因又叫咖啡碱,是一种生物碱,存在于茶叶、咖啡、可可等植物中。咖啡因是弱碱性化合物, 可溶于氯仿、丙醇、乙醇和热水中, 难溶于乙醚和苯(冷)。纯品熔点235~236℃,含结晶水的咖啡因为无色针状晶体,在100 ℃时失去结晶水并开始升华,120 ℃时显著升华,178℃时迅速升华。利用这一性质可纯化咖啡因。
(二)实验步骤
称取5g干茶叶, 装入滤纸筒内, 轻轻压实, 滤纸筒上口塞一团脱脂棉, 置于抽提筒中, 圆底烧瓶内加入60~80ml95%乙醇, 加热乙醇至沸,连续抽提1h,待冷凝液刚刚虹吸下去时, 立即停止加热。
将仪器改装成蒸馏装置, 加热回收大部分乙醇。然后将残留液 (大约l0~15ml) 倾入蒸发皿中, 烧瓶用少量乙醇洗涤, 洗涤液也倒人蒸发皿中, 蒸发至近干。加入4g 生石灰粉, 搅拌均匀, 用电热套加热(100~120V), 蒸发至干,除去全部水分。冷却后,擦去沾在边上的粉末, 以免升华时污染产物。
将一张刺有许多小孔的圆形滤纸盖在蒸发皿上, 取一只大小合适的玻璃漏斗罩于其上, 漏斗颈部疏松地塞一团棉花。
用电热套小心加热蒸发皿, 慢慢升高温度, 使咖啡因升华。咖啡因通过滤纸孔遇到漏斗内壁凝为固体, 附着于漏斗内壁和滤纸上。当纸上出现白色针 状晶体时, 暂停加热, 冷至100℃左右, 揭开漏斗和滤纸, 仔细用小刀把附着于滤纸及漏斗壁上的咖啡因刮入表面皿中。将蒸发皿内的残渣加以搅拌, 重新放好滤纸和漏斗, 用较高的温度再加热升华一次。此时 ,温度也不宜太高, 否则蒸发皿内大量冒烟, 产品既受污染又遭损失。合并两次升华所收集的咖啡因, 测定熔点。
(三)咖啡因的鉴定
(1)与生物碱试剂: 取咖啡因结晶的一半于小试管中, 加40ml水(微热)使固体溶解。分装于2支试管中, 一支加1~2滴5%鞣酸溶液, 记录现象)。另一支加1~2滴10%盐酸 (或10%硫酸), 再加入1~2滴碘—碘化钾试剂, 记录现象。
(2)氧化: 在表面皿剩余的咖啡因中, 加30%H2O2 8~10滴, 置于水浴上蒸干, 记录残渣颜色。再加一滴浓氨水于残渣上, 观察并记录颜色有何变化。
三、阿司匹林的合成
(一)实验原理
阿司匹林又名乙酰水杨酸,白色晶体,易溶于乙醇、氯仿和乙醚,微溶于水。具有解热、镇痛和消炎作用,可用于治疗伤风、感冒、头痛、发烧、神经痛、关节痛及风湿病等,也用于预防心脑血管疾病。
阿司匹林的合成,实验室通常采用水杨酸和乙酸酐在浓硫酸的催化下发生酰基化反应来制取,就是水杨酸分子中酚羟基的氢被乙酰基取代。水杨酸既含有羟基,又含有羧基,属于双官能团化合物。它既可以与羧酸及其衍生物作用,又可以与醇作用成酯,它本身分子间也可以形成氢键。为了加速反应的进行,破坏水杨酸分子间的氢键,常加入浓硫酸作催化剂。生成的阿司匹林粗品,用35%的乙醇溶液进行重结晶将其纯化。
反应如下:

(二)仪器药品
仪器:锥形瓶 电子天平 布氏漏斗 吸滤瓶 烧杯 真空泵 水浴锅 电热套 量筒 温度计 表面皿 玻璃棒 圆底烧瓶
药品:醋酐 冰水 碳酸氢钠 浓硫酸 浓盐酸 水杨酸
(三)实验步骤
(1)酰化 在干燥的锥形瓶中加入6g水杨酸和10mL乙酸酐,混匀后置于水浴中加热,在充分振摇下缓慢升温至75℃。保持此温度反应15min,期间仍不断振摇。最后提高反应温度至80℃,再反应5min,使反应进行完全。
(2)结晶抽滤 稍冷后拆下温度计。在充分搅拌下将反应液倒入盛有100mL水的烧杯中,然后冰水冷却,待结晶完全析出后,进行抽滤。用少量冷水洗涤滤饼两次,压紧抽干后转移到100mL烧杯中。
(3)重结晶 在盛有粗产品的烧杯中加入25mL35%乙醇,置于45~50℃水浴中加热,使其迅速溶解。若产品不能完全溶解,可酌情补加浓硫酸和乙酸酐。然后静置到室温,冰水冷却,待结晶完全析出后,进行抽滤。用少量冷水洗涤滤饼两次,压紧抽干。将结晶转移至表面皿中,自然晾干后称量,计算产率。
四,对乙酰氨基酚的合成
(一)实验仪器、试剂
仪器:1000ml烧杯 温度计 真空泵 量筒 水浴锅
试剂:氯化铵 苯丙醛 锌粉 苯 食盐 无水硫酸镁 醋酐
N-苯基羟胺 碳酸氢钠 乙醚 浓硫酸
(1)还原
1000ml烧杯上装置温度计、机械搅拌,加入8.4g氯化铵、266ml水,剧烈搅拌下加入14ml新蒸苯丙醛,然后加入20g锌粉,大约15分钟加完,温度自动上升,继续搅拌反应15分钟,趁热抽滤,以80ml热水洗涤滤渣。滤液加入食盐饱和,冰浴冷却约1小时,抽滤,用冷水洗涤,干燥后用苯重结晶,测熔点,计算收率。
(2)重排
在用冰盐浴冷却的1000ml烧杯中,加入10ml浓硫酸及30g冰,低温下加入2.2gN-苯基羟胺,然后加入200ml水,加热至沸反应15分钟,放冷用碳酸氢钠中和,食盐饱和,抽滤,用乙醚分别提取滤液及滤渣三次,合并提取液,用无水硫酸镁干燥。蒸干乙醚,得对氨基苯酚粗品。
(3)乙酰化反应
将5.5g对氨基苯酚粗品溶于15ml水中,加入6ml醋酐,剧烈振摇,水浴上加热10分钟,冷却后抽滤,冷水洗涤。用热水重结晶后测熔点,称重。
五、复方对乙酰氨基酚片的制备
(1)处方
阿司匹林26.8g 咖啡因3.34g 对乙酰氨基酚13.6g
淀粉26.6g 滑石粉1.5g 轻质液转石蜡0.025g 淀粉浆(17%)适量 总量100片
(2)制法
将对乙酰氨基酚,咖啡因与约1/3的淀粉和淀粉浆混匀(10-15分钟),制成均匀的软材,通过16目筛制粒。于70℃干燥,干粒通过12目筛。再将此粒与阿司匹林混合,加剩余的淀粉(预先在100-105度干燥)与吸附有液装石蜡的滑石粉混匀。再通过12目筛,易用12mm冲模压片。
3、可能出现的问题及解决办法
(1).压片时粘冲比较严重,造成性状不合格。解决方法:加入更多的滑石粉,提高淀粉浆浓度和充分干燥。
(2).可能出现松片。解决方法:调整压片机的压力,控制粘合剂的用量。
(3).崩解速度慢。主要是采用外加微晶纤维素来解决崩解问题。
六、复方对乙酰氨基酚片的质量分析
(一)设备和试剂:
电子天平、升降式崩解仪、溶出仪、锥形瓶、滴定管、玻璃棒、分液漏斗、容量瓶、分光光度计、移液管等
0.1mol/l HCL溶液 、0.4g/lNaOH稀硫酸、溴化钾、0.lmol/L亚硝酸钠液、氯仿、中性乙醇、0.1mol/L氢氧化钠液、淀粉指示液 、酚酞指示液、0.1 mol/L碘液等。
2、实验流程:
①、重量差异检查
②、崩解时限检查
③、溶出度的测定
④、含量测定
3、实验方法:
(1)重量差异检查
取复方对乙酰氨基酚片10片,精密称定总重量(算平均片重),记录,再分别精密称定每片的重量,记录(每片的重量与平均片重相比较)。
(2)崩解时限检查
取复方对乙酰氨基酚片6片于升降式崩解仪中崩解,记录崩解时间。
(3)溶出度的测定
量取1000ml 0.1mol/l HCL 溶液放入溶出杯中,取复方对乙酰氨基酚片6片精密称定,记录,投入六个转篮中,转速为每分钟100转,经30分钟时,分别量取溶液5ml滤过,初滤液弃去,精密量取续滤液1.5ml,置于 25ml 容量瓶中,用 0.4g/lNaOH 溶液定容,摇匀,以NaOH溶液作参比溶剂,照分光光度法,在257nm的波长处测定吸收度,按C8H9NO2的吸收系数为715计算出每片的溶出量。
附:计算公式:溶出量%=[(A/W)/(A*/W 平均)]×100%
(4)含量测定
取本品20片,精密称定,记录,研细,备用
——咖啡因的含量测定
精密称取上述细粉适量(约相当于咖啡因50mg),加稀硫酸5ml,振摇数分钟使咖啡因溶解,滤过,滤液置50ml容量瓶中,滤器与滤渣用水洗涤三次,每次5m1,合并滤液与洗液,精密加0.l ml/L 碘液25 m1,用水稀释至刻度,摇匀,在约25℃避光放置15分钟,摇匀,滤过,弃去初滤液,精密量取续滤液25m1置碘量瓶中,用0.05mol/L硫代硫酸钠液滴定,至近终点时,加淀粉指示液,继续滴定至蓝色消失,并将滴定结果用空白试验校正,即得。
(注:lml的0.1 mol/L碘液相当于5.305 mg的C8H10N4O2·H2O。)
公式如下:

(注:T为滴定度;V消耗滴定液体积;f为滴定液浓度校正因子)
——阿司匹林的含量测定
精密称取上述细粉适量(约相当于乙酰水杨酸0.4g),置分液漏斗中,加水15ml,摇匀,用氯仿振摇提取4次(20 ml,10 ml,10 ml,10ml),提取氯仿液用同一分水10ml洗涤,合并氯仿洗液,置水浴上蒸干,残渣加中性乙醇(对酚酞指示液显中性)20ml溶解后,加酚酞指示液3滴,用0.1mol/L氢氧化钠液滴定,即得。
(注:1ml 0.1mol/L氢氧化钠溶液相当于18.02mgC9H8O4。)
公式如下: 
(注:T为滴定度;V消耗滴定液体积;f为滴定液浓度校正因子)
——对乙酰氨基酚的含量测定
精密称取上述细粉适量(约相当于对乙酰氨基酚0.25 g),置锥形瓶中,加稀硫酸25 ml,缓缓加热回流60分钟,冷却至室温,将析出的水杨酸滤过,滤渣与锥形瓶用盐酸液(1→2)40ml,分数次洗涤,每次5m1,合并滤液与洗液,加溴化钾3g溶解后,将滴定管的尖端插入液面下约2/3处,在不低于20℃的温度下,用0.lmol/L亚硝酸钠液迅速滴定,随滴随搅拌,至近终点时,将滴定管尖端提出液面,用少量的水将尖端洗涤,洗液并入溶液中继续缓缓滴定,至用细玻棒蘸取溶液少许,划过涂有含锌碘化钾淀粉指示液的白瓷板上,即显蓝色的条痕,停止滴定,5分钟后再蘸取少许,划过一次,如仍显蓝色的条痕,即达终点。
(注:1ml0.1mol/L亚硝酸钠溶液相当于15.12mg的C8H9NO2。)
公式如下: 
(注:0.01512和0.1分别为亚硝酸钠溶液的实际浓度和理论浓度)
实验结果分析:
阿司匹林产率=(实际产量/理论产量)*100%=5.4/6*100%=90%,(本实验中乙酸酐过量,计算产率应以水杨酸为基准)
(1)重量差异检查
总片重=3.147g 平均片重=0.3147g
 序号 1 2 3 4 5 6 7 8 9 10
序号 1 2 3 4 5 6 7 8 9 10
 重量(g) 0.341 0.342 0.347 0.342 0.345 0.346 0.355 0.356 0.367 0.362
重量(g) 0.341 0.342 0.347 0.342 0.345 0.346 0.355 0.356 0.367 0.362 
(2)崩解时限
 序号 1 2 3 4 5 6
序号 1 2 3 4 5 6
 时间(min) 14 12 14 11 14 13
时间(min) 14 12 14 11 14 13
 (3)溶出度的测定
(3)溶出度的测定
6片总重:3.635 平均片重:0.605
 序号 1 2 3 4 5 6
序号 1 2 3 4 5 6
 重量(g) 0.613 0.593 0.617 0.594 0.593 0.625
重量(g) 0.613 0.593 0.617 0.594 0.593 0.625
 序号 1 2 3 4 5 6
序号 1 2 3 4 5 6
 吸光度(A) 7.51 7.029 7.614 7.05 7.03 7.811
吸光度(A) 7.51 7.029 7.614 7.05 7.03 7.811
 溶出量% : 85.7 82.9 86.3 83.1 82.9 87.4
溶出量% : 85.7 82.9 86.3 83.1 82.9 87.4
4、含量测定
20片总重:12.4872g 平均片重:0.624g
W样(g) A样 标示百分含量 (%) 平均含量(%) 相对平均偏差(%)
0.0512 0.592 100.97 100.9 0.03
0.0502 0.580 100.89
本品含C8H9N02应为标示量的95.0%~105.0%99.9%
现象观察并记录:
咖啡因的鉴定;
(1) 加1~2滴5%鞣酸溶液, 记录现象;咖啡因属于嘌呤衍生物,可被生物碱试剂鞣酸生成白色沉淀。
(2) 另一支加1~2滴10%盐酸 (或10%硫酸), 再加入1~2滴碘—碘化钾试剂, 记录现象:产生红褐色的沉淀。
(3) 在表面皿剩余的咖啡因中, 加30%H2O2 8~10滴, 置于水浴上蒸干, 记录残渣颜色。再加一滴浓氨水于残渣上, 观察并记录颜色有何变化。记录现象:咖啡因可被过氧化氢、氯酸钾等氧化剂氧化,生成四甲基偶嘌呤(将其用水浴蒸 干,呈玫瑰色),后者与氨作用即生成紫色的紫脲铵。该反应是嘌呤类生物碱的特性反应。
第二篇:对乙酰氨基酚分散片的制备及质量研究
对乙酰氨基酚分散片
制备及质量研究
摘要:
实验目的:通过正交试验设计筛选对乙酰氨基酚分散片处方工艺并进行质量检查。
实验方法:通过对羧甲基淀粉钠(CMS—Na)、低取代羟丙基纤维素(L—HPC)、交联聚乙烯吡咯烷酮(PPVP)、交联羧甲基纤维素钠(CMC—Na)进行试验,初选出制备中将使用的崩解剂,然后利用正交实验堆崩解剂的加入量、加入方式和粘合剂的加入量进行筛选,最后对制得的分散片进行质量检验。
优化处方:对乙酰氨基酚片9g,交联聚乙烯吡咯烷酮(PPVP)1.20g,聚乙烯吡咯烷酮(PVP)1.0ml PVP + 3.5ml乙醇,可压性淀粉4.65g,硬脂酸镁0.15g,制成30片。
质量检查:脆碎度合格,崩解度不合格,溶出度合格。所筛选处方合理,对生产出的片剂各指标检验,符合规定。崩解剂的种类、用量、加入方法及黏合剂等因素均对对乙酰氨基酚分散片的性能无明显影响。
关键词:对乙酰氨基酚;分散片;正交设计;处方筛选;质量检查
Abstract:
- 2 -
The purpose of the experiment: The orthogonal design of paracetamol tablet formulation processes and quality checks.
Experimental Methods: carboxymethyl starch sodium (CMS-Na), low substituted hydroxypropyl cellulose (L-HPC), cross-linked
polyvinylpyrrolidone (PPVP), cross-linked sodium carboxymethyl
cellulose (CMC-Na ) trial, primaries will be used for preparation of the disintegrating agent, and then using the orthogonal experimental
reactor disintegration agent dosage, addition method and amount of added binder to filter, and finally obtained the tablet on the quality inspection .
The optimized formulation: paracetamol tablets 9g, cross-linked
polyvinylpyrrolidone (PPVP) 1.20g, polyvinylpyrrolidone (PVP) 1.0ml PVP + 3.5ml of ethanol, compressible starch 4.65g, 0.15g magnesium stearate , made 30.
Quality Check: Friability qualified, unqualified disintegration,
dissolution qualified. The filter prescription is reasonable, on the
production of tablets of each index test, compliance. Disintegrating
type, dosage, adding methods and adhesives such factors contribute to acetaminophen tablet's performance remarkably.
Key words: acetaminophen; tablet; orthogonal design; prescription screening; Quality Check
- 3 -
分散片又称为水分散片是指遇水迅速崩解,形成均匀粘性的混悬溶液的一种片剂。分散片具有速崩、速效,服用方便 、制备工艺简单,稳定性强、高效等优点。
对乙酰氨基酚,为解热镇痛药。它是最常用的非甾体抗炎解热镇痛药,解热作用与阿司匹林相似,镇痛作用较弱,无抗炎抗风湿作用,是乙酰苯胺类药物中最好的品种。特别适合于不能应用羧酸类药物的病人。
正交试验设计(Orthogonal experimental design)是研究多因素多水平的一种设计方法,它是根据正交性从全面试验中挑选出部分有代表性的点进行试验,这些有代表性的点具备了“均匀分散,齐整可比”的特点,正交试验设计是分式析因设计的主要方法。是一种高效率、快速、经济的实验设计方法。
本实验采用湿法制粒压片,崩解剂的加入方式采用内外加法,处方组成的确定采用崩解时限为指标,对崩解剂和黏合剂的种类及用量进行筛选。对分散片质量检查的要求是:崩解时限、分散均匀性检查、溶出度检查。
1 仪器与试药
1.1 仪器
RCZ-8A智能药物溶出仪
FT-2000A脆碎度检查仪
16目尼龙筛
Q/BKYY31-2000电热恒温干燥箱
JP-A型架盘天平
- 4 -
升降式崩解仪
78X22 型片剂四用仪 UV22401PC分光光度计 UV29200紫外可见风光光度计
常用实验器材(容器及转移器具)
1.2 试药
对乙酰氨基酚原料药 羧甲基淀粉钠(CMS-Na)
硬酯酸镁
可压性淀粉
低取代羟丙基纤维素(L-HPC)
交联聚乙烯吡咯烷酮(PPVP)
交联羧甲基纤维素钠(CMC-Na)
其它常用分析用试剂
2 处方筛选方法与结果
2.1 药物处方设计
对乙酰氨基酚分散片处方:
对乙酰氨基酚 9.0g 可压性淀粉 4.6g(调整用) 崩解剂 0.75g(5%) - 5 - 主药 填充剂
硫脲 适量 抗氧剂
聚乙烯吡咯烷酮 5ml(10%) 黏合剂
硬酯酸镁 0.15g(1%) 润滑剂
制成 30片
2.2 制备工艺
将对乙酰氨基酚和可压性淀粉、崩解剂(适量)加入研钵中混合均匀,少量多次的把黏合剂(包含硫脲)加入到上述混合粉末中,制成软材,用力过16目尼龙筛,于50—60℃恒温干燥30分钟,用力压过16目筛整粒,将此颗粒与剩余的处方量崩解剂(用量根据崩解剂的加入方式确定)和硬脂酸镁混合均匀,压片。(片重为0.5g,其中对乙酰氨基酚为0.3g,硬度控制在4kg---6kg)
2.3 崩解剂的筛选
选取目前在固体制剂制备中常用的崩解剂(CMS—Na、PVPP、L—HPC、CMC—Na)进行分散片的制备(分散片处方见“2.1 分散片处方设计”,崩解剂用量3%,PVP用量1%,可压性淀粉调节片重至500mg,内加法,工艺见2.2)通过分散片的崩解时限测定及分散均匀性评价初步筛选崩解剂种类。 表 1 对乙酰氨基酚分散片处方中崩解剂筛选实验结果及分析
编号 CMS-N
a L-HPC PPVP CMC-N分散均匀性 崩解时限 a
1
2
3
5.0% 5.0% 5.0% - 6 - 全溶 全溶 全溶 11min 5.5min 5.0min
4 5.0% 全溶 13min
根据崩解时限及分散均匀性实验初步选择5%的PPVP为对乙酰氨基酚分散片的崩解剂。
2.4 分散片处方工艺筛选
根据可能影响分散片质量的组成及工艺因素,采用正交实验筛选处方工艺。本实验为三因素、三水平正交实验。
表 2 对乙酰氨基酚分散片处方工艺正交涉及筛选的因素水平表
水平
1 崩解剂用量(A) 2% 0.30g 聚乙烯吡咯烷酮用量(B) 1% 1.5ml PVP + 3.5ml
乙醇 崩解剂加入方式(C) 内加法
2 5% 0.75g 2% PPVP +
2ml乙醇 内、外加法
3 8% 1.20g 3%
5mlPPVP 外加法
注:崩解剂加入方式采用内、外加法时,内外加入量各占有崩解剂总量的50%
表3 对乙酰氨基酚分散片处方工艺正交设计实验安排表
试验编号 A B C 崩解时限,s
1 A1 B1 C1 360
- 7 -
2 A1 B2 C2 253 3 A1 B3 C3 330 4 A2 B1 C2 190 5 A2 B2 C3 240 6 A2 B3 C1 230 7 A3 B1 C3 360 8 A3 B2 C1 250 9 A3 B3 C2 275
K1 314 303 280 K2 220 248 239 K3 295 278 310 R 94 55 71
最终得出的最佳结果是A2B2C2
- 8 -
3 成品制备及其质量检查
3.1 根据以上实验所选取的最佳处方制备对乙酰氨基酚分散片。
对乙酰氨基酚分散片处方:(每组剂量,共 18实验组)
对乙酰氨基酚 9.0g 主药
可压性淀粉 4.5g 填充剂
PPVP 1.20g 崩解剂
硫脲 适量 抗氧剂
聚乙烯吡咯烷酮 1.5ml(加乙醇稀释至5ml) 粘合剂
硬酯酸镁 0.15g(1%) 润滑剂
制成 30片 采用内外加法
3.2 制备工艺
将对乙酰氨基酚和可压性淀粉、崩解剂(适量)加入研钵中混合均匀,少量多次的把黏合剂(包含硫脲)加入到上述混合粉末中,制成软材,用力过16目尼龙筛,于50—60℃恒温干燥30分钟,用力压过16目筛整粒,将此颗粒与剩余的处方量崩解剂(用量根据崩解剂的加入方式确定)和硬脂酸镁混合均匀,压片。(片重为0.5g,其中对乙酰氨基酚为0.3g,硬度控制在4kg---6kg)
3.3 对乙酰氨基酚分散片的质量检查
3.3.1 外观
表面完整光洁,色泽均匀,边缘整齐,符合规定。
3.3.2 片重差异
跟据《中国药典》(2005版),片重重量差异限度规定如下:平均重量 - 9 -
在0.3g以下的重量差异限度为±7.5℅, 平均重量在0.3g及0.3g以上的重量差异限度为±5℅。
取供试品20片,精密称定总的质量,求得平均片重后,随机选6片精密称定,每片重量与平均片重相比较(凡无含量测定的片剂,每片重量应该与标示片重比较),超出重量差异限度的不得多于2片,并不得有1片超出限度1倍
精密称定20片重量M=10.6600g 平均重量:0.5330g
表4 随机选6片
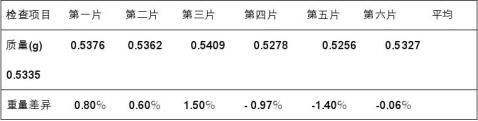
由以上表可知产品的平均重量大于0.5g,重量差异均在±5℅之间,因此产品片重无差异。
3.3.3 硬度
用四用仪测定产品硬度,位于4-6之间符合规定。
3.3.4 脆碎度
取产品20片,用吹风机吹去片剂上的粉末,然后精密称定,重量为:10.1120g,然后放入脆碎度检查仪定时4分钟,转动100圈,吹去片剂上的粉末,精密称定,重量为:10.0130g。
减失重量(%)=(10.112.-10.0.130)/10.112.=0.9790% < 1.0000%
且没有检出断裂,龟裂及粉碎的片,所以脆碎度合格。
- 10 -
3.3.5 溶出度
分别量取1000ml 0.1mol/L的盐酸置于6个溶出杯中,加热至37度恒温(模拟人体胃中温度及PH)。
取产品20片,精密称定,计算平均片重W,随即选6片,分别称重,记录,标号1、2、3、4、5、6。然后将称取的产品分别置于6个溶出杯中,溶出30分钟。然后分别用6支干燥洁净的注射器分别取5ml溶出液,用
0.8um滤膜过滤,分别用1ml的移液管量取1ml试液置于50ml的容量瓶中,用0.4mol/L氢氧化钠稀释至刻度,摇匀,以0.4mol/L的氢氧化钠作参比,测定6个试液在257nm处的吸光度。
然后将剩余的产品研细成粉,精密称取相当于平均片重的粉末,值
1000ml量瓶中加0.1mol/L盐酸适量,震摇是药片溶解,用0.1mol/L的盐酸定容至1000ml。干燥注射器取5ml通过0.8um滤膜过滤,将续滤液置于洁净干燥的试管中,用干燥洁净移液管取1ml试液置于50ml容量瓶中,用
0.4mol/L氢氧化钠稀释至刻度,摇匀。以0.4mol/L的氢氧化钠的吸光度作参比,测定其在257nm的吸光度A*
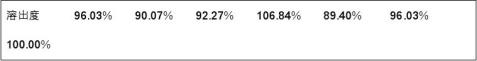
表5 6片在257nm处的吸光度A及溶出度
检查项目 第一片 第二片 第三片 第四片 第五片 第六片 对照 质量(g) 0.5376 0.5362 0.5409 0.5278 0.5256 0.5327 0.5346
吸光度A 0.435 0.408 0.418 0.484 0.405 0.435 0.453
- 11 -
平均溶出度=95.11% 六片无一超过80%,溶出合格。
3.3.6 崩解度
分别取12片分散片置于盛有足量盐酸的恒温的升降式崩解仪中,开动上下开关立即开始计时,观察并记录分散片全部溶出时间。
结果:分散片溶出时间大于三分钟,不符合规定(规定的在3分钟之内)。
4 小结
4.1总述
分散片处方组成中常用辅料主要包括填充剂,崩解剂和黏合剂。崩解剂和黏合剂的种类和用量选择,直接影响制剂在水中的崩解及分散均匀性。制备分散片以湿法制粒最为常用,处方中崩解剂的加入方式有内加法、外加法和内、外加法,其加入方式直接影响制剂在水中的崩解及分散均匀性。因此,分散片处方组成的确定通常采取以崩解时限为指标,对崩解剂和黏合剂的种类及用量和崩解剂加入方式来进行筛选。
4.2 讨论
《中华人民共和国药典》2005版(二部)规定如果做药物溶出检测则不必做崩解检测,但本次实验两项检测都做了,所得结论不一致。
由于最终压片所用材料为各组所整粒混合所得,操做上的差异对实验有一定的影响。而且溶出时温度与PH均模拟人体胃环境。由于时间与仪器的限制, - 12 -
崩解检测没有才有同样条件。崩解剂的主要机理有1毛细管作用2膨胀作用3润湿热4产气作用。水渗入到片剂内部是片剂崩解的首要条件,而水分的参入快慢与片剂内部的空隙状态和物料的润湿性有关,因此影响片剂崩解的主要因素是:
1压片时的压力大小;
2可溶性成分和润湿剂;
3无量压缩成型性和黏合剂;
4崩解剂。
制软材是黏合剂应分次加入,且要注意乙醇用量,应控制使软材达到“握之成团,轻触即散”的要求,将软材挤压过筛,颗粒应以无长条、块状和过多细粉为宜。
参考文献
1、崔福德,《药剂学》第六版,人民卫生出版社,2007.8。
2、凌春生,药剂学实验讲义。开封,河南大学药学院教研室,2007。
3、姚新成 等,对乙酰氨基酚分散片的处方考察,石河子大学学报(自然科学版)20xx年12月第25卷 第6期。
4、国家药典委员会,《中华人民共和国药典》2005版(二部),北京,化学工业出版社,2005。
- 13 -
- 14 -
-
实验三 解热镇痛药对乙酰氨基酚的合成
实验五解热镇痛药对乙酰氨基酚的合成一实验目的1掌握对乙酰氨基酚合成的原理和方法2学习热水重结晶提纯对乙酰氨基酚的操作方法3学习有机…
-
对乙酰氨基酚的制备及质量检查
对乙酰氨基酚分散片的制备及质量检查摘要目的考察制备对乙酰氨基酚分散片的最佳处方及工艺并进行药物质量检查方法通过单因素实验筛选对乙酰…
- 对乙酰氨基酚的制备
-
对乙酰氨基酚分散片的制备
药剂论文对乙酰氨基酚分散片制备及其质量检查指导教师姓名学号班级对乙酰氨基酚分散片的制备及质量研究摘要目的1熟悉正交设计法进行分散片…
-
对乙酰氨基酚分散片的制备及质量检查论文
河南大学药学院20xx级药剂学实验报告对乙酰氨基酚分散片的制备及质量检查论文作者姓名杨宪文作者学号所在学院药学院所学专业药物制剂指…
- 对乙酰氨基酚片的制备、含量测定与溶出速率测定
-
对乙酰氨基酚分散片的制备及质量检查论文
河南大学药学院20xx级药剂学实验报告对乙酰氨基酚分散片的制备及质量检查论文作者姓名杨宪文作者学号所在学院药学院所学专业药物制剂指…
-
实验三 解热镇痛药对乙酰氨基酚的合成
实验五解热镇痛药对乙酰氨基酚的合成一实验目的1掌握对乙酰氨基酚合成的原理和方法2学习热水重结晶提纯对乙酰氨基酚的操作方法3学习有机…
-
对乙酰氨基酚的制备及质量检查
对乙酰氨基酚分散片的制备及质量检查摘要目的考察制备对乙酰氨基酚分散片的最佳处方及工艺并进行药物质量检查方法通过单因素实验筛选对乙酰…
- 对乙酰氨基酚的制备