对乙酰氨基酚分散片的制备和质量检查
药剂学实验设计论文
论文作者姓名: 作者学号: 所在学院: 所学专业: 导师姓名: 论文完成时间:
对乙酰氨基酚分散片的制备和质量检查
[摘 要]通过考察不同处方分散片的崩解时间及分散均匀性初步筛选崩解剂种类,确定崩解剂最优为交联羧甲基纤维素钠(交联CMC-Na)。根据影响分散片质量的主要处方组成及工艺因素,采用正交设计法进行对乙酰氨基酚分散片的处方工艺筛选,并按正交试验表设计进行试验,对试验结果进行分析,考察个因素、水平对分散片质量的影响程度,优选出最佳的处方工艺条件。按照最佳处方工艺条件制备对乙酰氨基酚分散片,同时对分散片的质量进行检测。结果显示,7% 交联CMC-Na,1% PVP K10%醇溶液(不足用60%乙醇溶液补)和1%硬脂酸镁组成的处方为最优。
[关键词] 对乙酰氨基酚分散片 对乙酰氨基酚 分散片 对乙酰氨基苯酚 扑热息痛 N-(4-羟基苯基)乙酰胺 醋氨酚
[Abstract] By examining the different prescription dispersible tablets disintegration time and uniform dispersion to preliminarily selected disintegrating agents, determine the best disintegrating agent is cross-linked carboxymethyl cellulose sodium (cross-linked CMC-Na). According to the main component prescription and technological factors on the dispersible tablets quality, by orthogonal design to select the prescription process of Paracetamol Dispersible Tablets. Then according to the orthogonal table to design and do erperiment and analyze experimental resulta. Investigated single factor and level for degree of influence of the quality of dispersible tablets. To manufacture Paracetamol Dispersible Tablets in accordance with the best conditions of prescription process. Conclusion:the optimum formulation is based on 7% of the cross-linked CMC-Na, 1% PVP K10(complemented by 60% ethanol if inadequate )as excipients in dispersible tablets.
[Key words] Paracetamol Dispersible Tablets;Paracetamol;Dispersible Tablets;4-Acetamino phenol;Paracetamol;N-(4-hydroxyphenyl)-Acetamide;P-acetamidophenol
分散片又称为水分散片是指遇水迅速崩解,形成均匀粘性的混悬溶液的一种片剂
[1]。一般对分散片质量检查的要求是:崩解时限、分散均匀性检查、溶出度检查、脆
- 1 -
碎度[1,2]。对乙酰氨基酚(Acetaminophen)又称扑热息痛(paracetamolum APAP),是临床上使用的较为广泛的解热镇痛药。由于该药物在水中溶解度较小且在水溶液存在稳定性问题,同事该药物吸收血药达峰时为10~60min[3] 。我们在借鉴姚新成[4]等人研究对乙酰氨基酚分散片的基础上, 试制对乙酰氨基酚分散片。
1. 材料和方法
1.1 仪器与试药
1.1.1 仪器
单冲压片机,片剂四用仪,RCZ-8A型智能药物溶出仪(天津大学精密仪器厂),LB-2B型崩解时限测定仪(上海黄海药检仪器厂),FT-2000A脆碎度检查仪(天津大学无线电厂),紫外可见分光光度计,分析天平(电子天平),尼龙筛(16目),烘箱等。
1.1.2 试药
对乙酰氨基酚,可压性淀粉,硫脲,羧甲基淀粉钠(CMS-Na),交联聚乙烯吡咯酮(PPVP),低取代羟丙基纤维素(L-HPC),交联羧甲基纤维素钠(CMC-Na),聚乙烯比咯烷酮K10(PVP K10),硬脂酸镁,60%乙醇,蒸馏水等。
1.2 试验方法
1.2.1 处方工艺筛选
全班同学共同查阅资料,每个人设计一份合理的处方工艺,综合所有的处方工艺筛选出最优的处方工艺设计。
1.2.2 崩解剂的筛选
选取目前在固体制剂制备中常用的崩解剂:羧甲基淀粉钠(CMS-Na)、交联聚乙烯比咯烷酮(PPVP)、低取代羟丙基纤维素(L-HPC)、交联羧甲基纤维素纳(交联CMC-Na);粘合剂:聚乙烯比咯烷酮K10(PVP K10),进行分散片得制备,分散片的处方如下:
对乙酰氨基酚 5.0g
崩解剂 (5%) 1.0g
粘合剂 (3%) 0.6g
可压性淀粉 13.2g
硬脂酸镁 (1%) 0.2g
硫脲(随粘合剂加入)
- 2 -
制成50片
其中崩解剂的加入方式为内加法。通过崩解时限及分散均匀性评价初步筛选崩解剂种类。
按《中国药典》(2010版)的方法[1]进行崩解实验,结果见表1。 表1: 崩解实验结果表
崩解剂 分散均匀性 崩解时限
CMS-Na 均匀 2′58″
PPVP 均匀 5′27″
L-HPC 均匀 7′58″
CMC-Na 均匀 2′33″
1.2.3 分散片处方工艺筛选考察因素及其水平(正交设计实验法)
在上述崩解剂筛选试验的基础上, 采用正交设计实验法进行处方工艺筛选。试验因素、水平设计及实验安排见表2。
表2:
表3: 正交试验结果分析
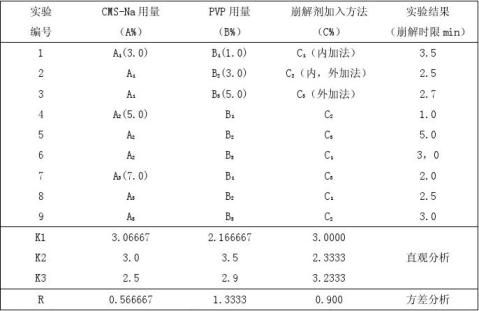
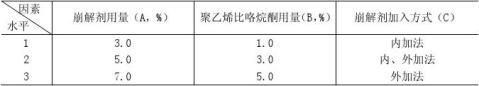
由表2可知:影响因素由R值大小可分析出因素对崩解时限影响大小顺序:B>C>A
- 3 -
由实验结果可推出最优处方为:A3B1C2
即最优处方:
对乙酰氨基酚 5g
交联CMC-Na(7%) 1.4g
10%PVP(含硫脲)(1%) 0.2g
可压性淀粉 13.2g
硬脂酸镁1% 0.2g
硫脲(随粘合剂加入)
制成50片
1.2.4 对乙酰氨基酚分散片的制备
将对乙酰氨基酚5.0g、可压性淀粉13.2g、羧甲基淀粉钠0.6g在研钵中混合均匀,然后加入0.2g10%PVP(不足用60%乙醇溶液补足)到上述混合粉末中,混合制成均匀的软材,过18目尼龙筛制湿颗粒。将湿粒于50~60℃干燥30min,18目筛整粒,将此颗粒与剩余0.6g羧甲基淀粉钠和0.3硬脂酸镁混合均匀,压片(片重为0.4g,硬度为5kg)。
1.2.5 对乙酰氨基酚分散片的质量检查
1.2.5.1 外观
表面完整光洁,色泽均匀,边缘整齐。
1.2.5.2 硬度
手工检查:取药片置于中指食指间,用拇指以适当压力挤压片子,无立即开裂 四用仪测定:硬度为5.5kg,符合要求
1.2.5.3 分散均匀性
取分散片置20±1℃的250ml水中,振摇三分钟,不符合要求
1.2.5.4 脆碎度
方法:采用转栏法,左右各17片,取供试品17片,吹去表面粉末,精密称定。转栏速度25r/min,时间4min。取出,吹去粉末,精密称定。
(《中国药典》(2010版):减失重量不得过1%,且不得检出断裂,龟裂及粉碎的片。本实验一般仅作一次,如减失重量超过1%,应复检2次,三次的平均重量不得过1%,并不得检出断裂,龟裂及粉碎的片。[1])
结果:左边转栏碎一片,检查前片重8.19g,检查后片重7.46g,减失重量8.9%;右转栏碎一片,三片裂片,检查前片重8.2g0检查后片重7.24g,减失重量11.7%。结果不符合规定。
- 4 -
1.2.5.5 片重差异
方法:取20片精密称定总重量,分别精密称定各片重,进行片重比较
(据《中国药典》(2010版)规定,片剂重量差异的限度规定如下:平均重量0.30g以下的重量差异限度为±7.5%,0.30g或0.30g以上的为±5%;超出重量差异限度的药片不得多于两片,并不得有一片超出限度的一倍。)
表4: 平均片重: 0.4959g

《中国药典》(2010版)规定20片中超过上限的片数不得多于两片,并不得有一片超过平均限度一倍,而重量差异限度为±5%。由此可知制得的对乙酰氨基酚分散片片重差异检查合格。
1.2.5.6 崩解度
方法:取分散片6片置崩解时限测定仪中,设置温度37±1℃,往返速度为30~32次/min开动仪器测定分散片的崩解时限,之全部崩解过筛,记录时间为25min
(《中国药典》(2010版)规定:各片均应在15min内全部溶解或融化) 结果:崩解度不符合规定。 1.2.5.7 溶出度
① 比较值A* (吸收度)的测定
- 5 -
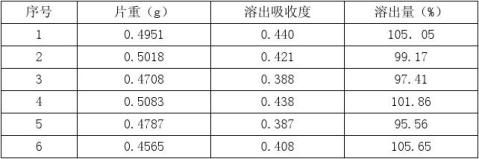
取20片,精称,测得总重10.01g,平均片重0.50051g。研细,精称0.5000g,置1000ml量瓶中,加0.1mol/L HCL至刻度,摇匀(取5ml溶液用微孔滤膜滤过,吸取续滤液1.5ml置25ml量瓶中,用0.4g/LNaOH稀释至25ml,摇匀,以0.4g/L NaOH为参比测定吸收度为0.423
② 溶出度测定
量取1000ml0.1mol/LHCL,加热至37℃,利用转篮法,调整转速100r/min。取六片药,精称投入六个转篮中,当转篮浸入溶出介质时,开时计时,在30min时取样5ml按上述测定方法测定吸收度。
出量的计算
溶出量(%)=[(A×W*)/(A*×W)]×100% 表5: A*: 0.423 W*: 0.50 g 《中国药典》(2010版)二部附录XC溶出度测定法项下的规定,具体判断方法如下:
符合下述条件之一者,可判为符合规定:
① 6片中,每片的溶出量按标示量计算,均不低于规定限度。
② 6片中有1~2片低于规定限度,但不低于规定限度-10%,且其平均溶出量不低于规定限度
③ 6片中有1~2片低于规定限度,其中有1片低于规定限度-10%,且不低于规定限度-20%,且其平均溶出量不低于规定限度时,应另取6片复试,初、复试的12片中有1~3片低于规定限度,其中仅有1片低于规定限度-20%,且其平均溶出量不低于规定限度。
由结果可发现各溶出量百分比不仅均接近百分之百,甚至有个别超出百分百,因此可得出数据有明显错误,测定不准确,无法得出可信结果,该项检查失败。
2. 结论
- 6 -
本实验筛选出最优崩解剂为交联羧甲基纤维素钠(交联CMC-Na)。最佳处方工艺为崩解剂(交联CMC-Na)7%,粘合剂(PVP K10)1%,粘合剂的加入方式为内、外加法。但是按照最优处方及工艺制得的对乙酰氨基酚分散片并对其进行质量检查,检查结果除外观、硬度检查和片重差异检查合格外均不符合标准,因此该处方可操作性差。
3. 讨论
通过对对乙酰氨基酚分散片处方中崩解剂筛选试验结果分析选择交联羧甲基纤维素钠(交联CMC-Na)作为崩解剂。
分散片由于要达到特定的分散效果(分散片2片,置于100ml水中振摇,在20±1℃水中,3min应全部崩解并通过2号筛),其制备工艺一方面要有好的分散均匀性,另一方面也要达到一般制剂的要求(比如:硬度、脆碎度、外观),。因此在制备过程中可供选择的范围不大,要去准确控制处方工艺过程。处方和工艺充分考虑了各种因素的结果,制备出的分散片分散均匀性、硬度、脆碎度、外观均较好。通过比较研究得出的最优处方为A3B1C2。
理论上,按照最优处方A3B1C2的制备工艺制备出的对乙酰氨基酚分散片应完全符合标准,但实验结果却与理论不符。出现这种现象,是因为本实验应一个人独自完成整个操作过程,但是由于实验条件与实验时间的限制,需要大家配合完成实验。在这一过程中,每个人所感觉的软材湿度,粒度大小,压片的硬度等都会不同。还有测定分散均匀性时振摇的力度与速度均不同,造成实验数据偏差,实验结果不精确,致使崩解剂筛选错误。
参考文献:
[1] 国家药典委员会编.中华人民共和国药典(二部20xx年版)[M].北京:中国医
药科技出版社,2010.
[2] 黄胜炎.分散片进展[J] .中国药学杂志,1992,27(4):226-228.
[3] 姚新成,徐玉华,韩汝春等.对乙酰氨基酚分散片的处方考察[J] .石河子大学
学报(自然科学版),2007,25(6):684-686.
[4] 凌春生.药剂学实验指导.开封:河南大学药学院药剂教研室,2007.
[5] 崔福德.药剂学(第6版)[M] .北京:人民卫生出版社,2008.
- 7 -
第二篇:实验题目 复方对乙酰氨基酚片的质量分析1
复方对乙酰氨基酚片的质量分析
实验设计
一、实验题目 复方对乙酰氨基酚片的质量分析
二、实验目的:
1、了解复方对乙酰氨基酚片质量分析方法;
2、了解复方对乙酰氨基酚片的一些常规检查及测定;
3、掌握复方对乙酰氨基酚片各成分含量测定的基本原理和操作方法;
4、掌握复方对乙酰氨基酚片的分析特点。
三、实验原理(或依据):
复方对乙酰氨基酚片中含有对乙酰氨基酚、乙酰水杨酸和咖啡因三种主成分。
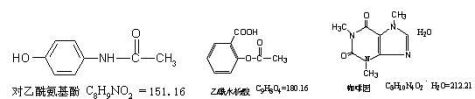
反应式表示如下:
对乙酰氨基酚的测定原理(重氮化法)
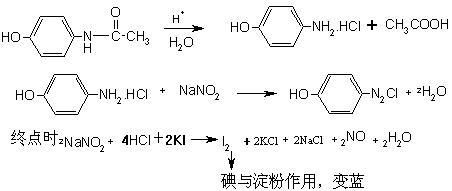
乙酰水杨酸的测定原理(酸量法)

咖啡因的测定原理(碘量法)
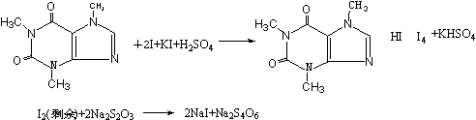
四、主要设备和试剂:
电子天平、升降式崩解仪、溶出仪、锥形瓶、滴定管、玻璃棒、分液漏斗、容量瓶、分光光度计、移液管等
0.1mol/l HCL 溶液 0.4g/lNaOH 稀硫酸 溴化钾 0.lmol/L亚硝酸钠液 氯仿 中性乙醇 0.1mol/L氢氧化钠液 淀粉指示液 酚酞指示液 0.1 mol/L碘液等
五、实验流程:
1、重量差异检查
2、崩解时限检查
3、溶出度的测定
4、含量测定
六、实验方法:
1、重量差异检查
取复方对乙酰氨基酚片10片,精密称定总重量(算平均片重),记录,再分别精密称定每片的重量,记录(每片的重量与平均片重相比较)。
2、崩解时限检查
取复方对乙酰氨基酚片6片于升降式崩解仪中崩解,记录崩解时间。
3、溶出度的测定
量取1000ml 0.1mol/l HCL 溶液放入溶出杯中,取复方对乙酰氨基酚片6片精密称定,记录,投入六个转篮中,转速为每分钟100转,经30分钟时,分别量取溶液5ml滤过,初滤液弃去,精密量取续滤液1.5ml,置于 25ml 容量瓶中,用 0.4g/lNaOH 溶液定容,摇匀,以NaOH溶液作参比溶剂,照分光光度法,在257nm的波长处测定吸收度,按C8H9NO2的吸收系数为715计算出每片的溶出量。 附:计算公式:溶出量%=[(A/W)/(A*/W 平均)]×100%
4、含量测定
取本品20片,精密称定,记录,研细,备用
A. 对乙酰氨基酚的含量测定
精密称取上述细粉适量(约相当于对乙酰氨基酚0.25 g),置锥形瓶中,加稀硫酸25 ml,缓缓加热回流60分钟,冷却至室温,将析出的水杨酸滤过,滤渣与锥形瓶用盐酸液(1→2)40ml,分数次洗涤,每次5m1,合并滤液与洗液,加溴化钾3g溶解后,将滴定管的尖端插入液面下约2/3处,在不低于20℃的温度下,用0.lmol/L亚硝酸钠液迅速滴定,随滴随搅拌,至近终点时,将滴定管尖端提出液面,用少量的水将尖端洗涤,洗液并入溶液中继续缓缓滴定,至用细玻棒蘸取溶液少许,划过涂有含锌碘化钾淀粉指示液的白瓷板上,即显蓝色的条痕,停止滴定,5分钟后再蘸取少许,划过一次,如仍显蓝色的条痕,即达终点。每lml的0.l mol/L亚硝酸钠液相当于15.12mg的C8H9NO2。
按下式计算每片含对乙酰氨基酚的克数:
式中:0.01512为亚硝酸钠液的实际浓度,0.1为亚硝酸钠液的理论浓度
B. 乙酰水杨酸的含量测定


精密称取上述细粉适量(约相当于乙酰水杨酸0.4g),置分液漏斗中,加水15ml,摇匀,用氯仿振摇提取4次(20 ml,10 ml,10 ml,10ml),提取氯仿液用同一分水10ml洗涤,合并氯仿洗液,置水浴上蒸干,残渣加中性乙醇(对酚酞指示液显中性)20ml溶解后,加酚酞指示液3滴,用0.1mol/L氢氧化钠液滴定,即得。每1ml 0.1mol/L氢氧化钠液相当于18.02mg的C9H8O4。
按下式计算每片含乙酰水杨酸的克数
其中:T为滴定度;V消耗滴定液体积;f为滴定液浓度校正因子 C. 咖啡因的含量测定
精密称取上述细粉适量(约相当于咖啡因50mg),加稀硫酸5ml,振摇数分钟使咖啡因溶解,滤过,滤液置50ml容量瓶中,滤器与滤渣用水洗涤三次,每次5m1,合并滤液与洗液,精密加0.l ml/L 碘液25 m1,用水稀释至刻度,摇匀,在约25℃避光放置15分钟,摇匀,滤过,弃去初滤液,精密量取续滤液25m1置碘量瓶中,用0.05mol/L硫代硫酸钠液滴定,至近终点时,加淀粉指示液,继续滴定至蓝色消失,并将滴定结果用空白试验校正,即得。
每lml的0.1 mol/L碘液相当于5.305 mg的C8H10N4O2·H2O。
按下式计算每片含咖啡因的mg数
七、可能出现的问题和解决方法:
1、崩解速度慢,可能是由于加入了过多的滑石粉或淀粉浆浓度提高或者干燥时间延长都会导致片剂变硬,可以通过外加微晶纤维素解决。 2、滴定终点判断不准确,可以重做。
八、记录内容和方式:
实验时间: 实验地点: 环境温度: 环境湿度: 原始结果记录:
1、 重量差异 10片平均片重:
序号
重量(g) 2、 崩解时限 序号
时间(min)
3、溶出度的测定
6片总重: 平均片重: 序号
重量(g)
总
重
:
序号
吸光度(A)
4、含量测定
20片总重: 平均片重:
A、V: 称样量:
B:V: 称样量:
C:V空 : V样 : 称样量:
现象观察并记录:主要是含量测定中接近滴定终点现象观察及判断。
九、预期结果:
1、 重量差异检查 超出重量差异限度的不多于2片,没有1片超出限度1倍。
2、 崩解时限检查 全部崩解,且不超过15分钟。
3、 溶出度测定 每片的溶出量按标示量计算,均不低于规定限度。
4、含量测定 复方对乙酰氨基酚片中含有对乙酰氨基酚、阿司匹林和咖啡因三种主成分含量都符合药典规定。
十、统计方法:
1、重量差异检查
片剂的平均重量(g) 片剂的差异限度(%
<0.30 ±7.5
≥0.30 ±6.0
2、崩解时限检查
普通片崩解时限为15 min。
3、溶出度的测定
片剂在45分钟内溶出标示量的70%以上。
4、 含量测定
A. 药典规定每片检品中含对乙酰氨基酚应为0.120g~0.132g。
B. 药典规定每片检品中含乙酰水杨酸应为0.219g~0.242g。
C. 药典规定每片检品中含咖啡因应为27.0~31.5mg。
-
实验三 解热镇痛药对乙酰氨基酚的合成
实验五解热镇痛药对乙酰氨基酚的合成一实验目的1掌握对乙酰氨基酚合成的原理和方法2学习热水重结晶提纯对乙酰氨基酚的操作方法3学习有机…
-
对乙酰氨基酚的制备及质量检查
对乙酰氨基酚分散片的制备及质量检查摘要目的考察制备对乙酰氨基酚分散片的最佳处方及工艺并进行药物质量检查方法通过单因素实验筛选对乙酰…
- 对乙酰氨基酚的制备
-
对乙酰氨基酚分散片的制备
药剂论文对乙酰氨基酚分散片制备及其质量检查指导教师姓名学号班级对乙酰氨基酚分散片的制备及质量研究摘要目的1熟悉正交设计法进行分散片…
-
对乙酰氨基酚分散片的制备及质量检查论文
河南大学药学院20xx级药剂学实验报告对乙酰氨基酚分散片的制备及质量检查论文作者姓名杨宪文作者学号所在学院药学院所学专业药物制剂指…
- 对乙酰氨基酚片的制备、含量测定与溶出速率测定
-
对乙酰氨基酚分散片的制备及质量检查论文
河南大学药学院20xx级药剂学实验报告对乙酰氨基酚分散片的制备及质量检查论文作者姓名杨宪文作者学号所在学院药学院所学专业药物制剂指…
-
咖啡因的提取,复方对乙酰氨基酚片 的制备及质量分析
题目咖啡因的提取复方对乙酰氨基酚片药学专业综合实验的制备及质量分析学院班级姓名学号一复方对乙酰氨基酚的概述复方对乙酰氨基酚主要成分…
-
实验三 解热镇痛药对乙酰氨基酚的合成
实验五解热镇痛药对乙酰氨基酚的合成一实验目的1掌握对乙酰氨基酚合成的原理和方法2学习热水重结晶提纯对乙酰氨基酚的操作方法3学习有机…
-
对乙酰氨基酚的制备及质量检查
对乙酰氨基酚分散片的制备及质量检查摘要目的考察制备对乙酰氨基酚分散片的最佳处方及工艺并进行药物质量检查方法通过单因素实验筛选对乙酰…